
锂离子电池已经成为应用最广泛的可充电电池。某种锂离子电池的结构示意图如图,其中两极区间的隔膜只允许Li+通过。电池充电时的总反应化学方程式为:LiCoO2 === Li1-xCoO2+xLi。关于该电池的推论错误的是( )
A.放电时,Li+主要从负极区通过隔膜移向正极区
B.放电时,负极反应xLi-xe-= xLi+
C.充电时,有电能转化为化学能
D.充电时,负极(C)上锂元素被氧化
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
全钒液流储能电池(VBR)广泛应用于风能、太阳能发电系统的储能系统。电池反应为

VO2++V2++2H+ VO2++V3++H2O,下列说法正确的是 ( )
A.该电池属于一次电池
B.电池工作时,H+由正极流向负极
C.电池放电时,负极的电极反应为VO2++H2O=== VO2++2H++e-
D.电池充电时,阴极的电极反应为V3++e-=== V2+
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制备溴苯可用如图所示的装置,填写下列空白:

(1)关闭F夹,打开C夹,在装有少量苯的三口烧瓶中由A口加入少量溴,再加入少量铁屑,塞住A口,反应一段时间制的溴苯。溴苯是一种密度比水 (填”小”或”大”)的无色液体,在实验中因为 而显褐色。则三口烧瓶中发生反应的化学方程式为__ ___和_ __。
(2)D、E试管内出现的现象为_____________________________________。
(3)待三口烧瓶中的反应进行到仍有气泡冒出时松开F夹,关闭C,可以看到的现象是____________________________________。
(4)三口烧瓶中的溴苯经过下列步骤分离提纯:
①向三口烧瓶中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是______________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_ __。
(5) 经过上述分离操作后,粗溴苯中还含有的主要杂质为_____________,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母):
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与Y同主族。下列说法正确的是( )
A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、W形成的化合物中化学键类型相同
C.Y的气态简单氢化物的热稳定性比W的强
D.X的最高价氧化物对应水化物的酸性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个绝热的密闭容器中,发生反应:X(g)+3Y(g)  2Z(g) △H>0。进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是( )
2Z(g) △H>0。进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是( )
A. 等压时,通入惰性气体,Z的物质的量不变
B. 等压时,通入Z气体,容器内温度改变
C. 等容时,通入惰性气体,反应速率不变
D. 等容时,通入Z气体,Y的物质的量浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.已知甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.常温下反应C(s)+CO2(g)=2CO(g)不能自发进行是由于该反应△H>0
C.中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小
D.已知2NaOH(aq)+H2SO4(aq) = Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol,则该反应的中和热为114.6 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
①下列收集Cl2的正确装置是 。
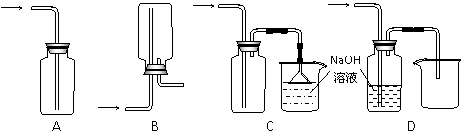

②已知氯水和SO2均具有漂白性,但两者同时使用漂白性却降低,用化学方程式解释原因_____________________________________________。
③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,
_____________________________________________________。
(2)能量之间可以相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池的装置示意图(见下图甲),并作相应标注。


甲
要求:在同一烧杯中,电极与溶液含相同的金属元素。
②铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 。
③甲乙两种原电池中可更有效地将化学能转化为电能的是 ,其原因是
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选
作阳极。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有机物中,既能发生加成反应,又能发生酯化反应,还能被新制Cu(OH)2悬浊液氧化的物质是
A.CH3=CH—CHO B.CH3CH2COOH
C.CH2=CH—COOCH3 D.CH2OH(CHOH)4CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
Ⅰ.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为
_____________________________________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A.铁 B.铝 C.铂 D.玻璃
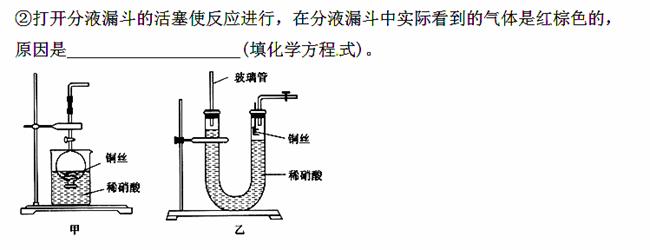 (3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反就开始后,可以在U形管右端观察到无色的NO气体。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反就开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是___________________________________。
②让反应停止的操作方法及原因是________________________。
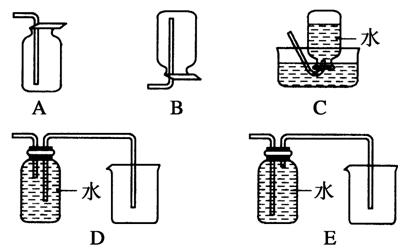
(4)以下收集NO气体的装置,合理的是________(填选项代号)。
(5)假设实验中12.8 g Cu全部溶解,需要通入标况下________mL O2才能使NO全部溶于水。
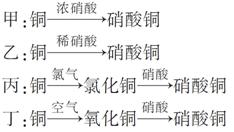
Ⅱ.用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”、“乙”、“丙”或“丁”),理由是___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com