
| A. | ( NH4 )2SO4 | B. | NaHCO3 | C. | Ba Cl2 | D. | Cu SO4 |
分析 根据钠的化学性质:与水、酸、盐溶液的反应,利用2Na+2H2O=2NaOH+H2↑,根据生成的氢氧化钠与选项中物质的反应判断反应现象.
解答 解:A、钠能与溶液中的水反应2Na+2H2O=2NaOH+H2↑,生成的氧化钠与硫酸铵反应生成氨气,所以有气体产生,没有沉淀生成,故A错误;
B、钠与水反应2Na+2H2O=2NaOH+H2↑,有气体生成,氢氧化钠与碳酸氢钠反应生成碳酸钠与水,没有沉淀产生,故B错误;
C、钠能与溶液中的水反应2Na+2H2O=2NaOH+H2↑,有气体产生,氢氧化钠不与氯化钡反应,没有沉淀生成,故C错误;
D、因为钠的化学性质活泼,投入硫酸铜溶液中后,钠首先与水反应生成氢氧化钠和氢气,然后氢氧化钠与硫酸铜生成氢氧化铜蓝色的沉淀,故D正确.
故选D.
点评 本题考查元素化合物的性质,比较简单,钠与碱、盐的反应中首先考虑与溶液中的水反应,然后再看生成的氢氧化钠能否与碱、盐本身反应.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向CaCl2溶液中通入少量CO2气体:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 碳酸钠溶液与硫酸氢钠溶液反应:CO32-+H+═CO2↑+H2O | |
| C. | Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向FeBr2溶液中通入足量的Cl2:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2是非极性分子 | B. | CS2的沸点高于CO2 | ||
| C. | CS2不能在空气中燃烧 | D. | CS2能证明非金属性S>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN溶液:酸性KMnO4溶液 | B. | NaOH溶液:Fe粉 | ||
| C. | KSCN溶液:NaOH溶液 | D. | 氨水:NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应过程 | 反应现象 | 离子方程式 |
| A | 金属镁与稀盐酸反应 | 有气泡逸出 | Mg+2H++2C-═MgCl2+H2↑ |
| B | 氣化钡溶液与稀硫酸反应 | 有白色沉淀生成 | Ba2++SO42-═BaS04↓ |
| C | 碳酸钠与盐酸反应 | 有气泡逸出 | Na2C03+2H+═CO2↑+H20+ 2Na+ |
| D | 硫酸铜溶液中加入过量的NaOH溶液 | 有白色沉淀产生 | Cu2++20H-═Cu(0H)2↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
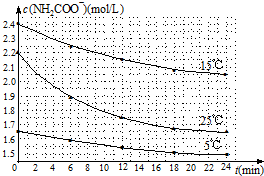
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2溶于水:3NO2+H2O=2H++2NO3-+NO | |
| B. | 用惰性电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+4H++O2↑ | |
| C. | NaClO溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3- | |
| D. | NaAlO2溶液中通入过量的CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ag+、CO32-、Cl- | B. | K+、Ba2+、SO42-、Cl- | ||
| C. | Na+、K+、CO32-、Cl- | D. | Na+、K+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com