
(15分)某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下:

(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如右图所示。考虑生产成本和效率,最佳的浸出时间为 小时,最佳的浸出温度为 ℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4; CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)= 。
(4)“沉淀”中含杂质离子主要有 ;“操作X”名称为 。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2+ C6 CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
(1)12 ; 90 ; (2)3,6,6,1,5,6;(3)1.50;
(4)SO42-、NH4+、Na+、F-; 洗涤、干燥 ;(5)0 ;7g
解析试题分析:(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如右图所示。由图可知:温度越高,浸出率越高,时间越长,浸出率。但是考虑生产成本和效率,最佳的浸出时间为12小时;最佳的浸出温度为90 ℃;(2)用化合价升降法配平化学方程式为3Fe2(SO4)3+6H2O+6Na2CO3= Na2Fe6(SO4)4(OH)12↓+ 5Na2SO4+ 6CO2↑;(3)KSP(CaF2)= c(Ca2+)×c2(OH-)=1.11×10-10; KSP(MgF2)= c(Mg2+) ×c2(OH-)=7.40×10-11,所以c(Ca2+)/c(Mg2+)= KSP(CaF2)÷KSP(MgF2)= 1.11×10-10÷7.40×10-11=1.50;(4)由于沉淀是从含有SO42-、NH4+、Na+、F-离子的溶液中过滤出来的,所以“沉淀”中含杂质离子主要有SO42-、NH4+、Na+、F-。把沉淀表面的杂质离子洗去、然后干燥就得到固体CoC2O4·2H2O。因此“操作X”名称为洗涤、干燥。(5)因为在充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,所以LiC6中Li的化合价为价;若放电时有1mole-转移,则有1mol的Li变为Li+结合为LiCoO2,所以正极质量增加7g。
考点:考查物质制备条件的选择、化学方程式的配平、在溶液中离子浓度的关系、混合物分离的操作、锂离子电池的工作原理的知识。


科目:高中化学 来源: 题型:单选题
下列关于pH=12的Na2CO3溶液说法正确的是
| A.升高溶液温度,溶液pH增大 |
| B.c(Na+) +c(H+)=c(CO32-)+ c(HCO3-)+ c(OH-) |
| C.溶液中c(OH-)>c(HCO3-)> c(H+) |
| D.2c(Na+)=c(CO32-)+ c(HCO3-)+ c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于0.1 mol·L-1CH3COONa溶液的说法正确的是 ( )
| A.加入少量NaOH固体,c(CH3COO-)增大 |
| B.加入少量FeCl3固体,c(CH3COO-)增大 |
| C.稀释溶液,溶液的pH增大 |
| D.加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)AgNO3的水溶液呈酸性的原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有 ,其浓度由大到小的顺序为 ,氨水的浓度a 0.01 mol·L-1(填“>”、“<”或“=”)。
(3)用已知浓度的NaOH标准溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
| A.未用标准液润洗碱式滴定管; |
| B.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液; |
| C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗; |
| D.滴定终点读数时,俯视滴定管的刻度,其它操作均正确; |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的NaHSO4,测得混合溶液的部分pH如下表所示:
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
 )>c(
)>c( )>c(
)>c( )>c(
)>c( )>c(
)>c( )
) )+c(
)+c( )=c(
)=c( )+2c(
)+2c( )+c(
)+c( )
) )+c(
)+c( )=c(
)=c( )+c(
)+c( )
) )、c(
)、c( )、c(
)、c( )分别相等
)分别相等查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在稀氨水中存在下述电离平衡NH3+H2O NH3 ·H2O
NH3 ·H2O NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
| 加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
| c(OH-)的变化 | | | |
| 平衡移动方向 | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)锗及其某些化合物是导弹火箭制导中的重要光电材料,工业上生产锗的流程如下:
已知:GeO2与浓盐酸反应生成四氯化锗(熔点为—51.5℃,沸点为86.6℃)。四氯化锗易水解。
(1)步骤②中浓盐酸除了作为反应物外,还有一个重要作用是 。
(2)步骤③控制的温度范围 。
(3)写出反应的④、⑥的化学方程式
④ ;⑥ 。
(4)生产过程中可以循环利用的物质是 (填化学式)
(5)步骤①中产生的SO2可以用碱液吸收,请写出离子反应方程式 。
(6)请简要描述实验室中操作a的过程 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。下图为,H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC—pH图。请回答下列问题: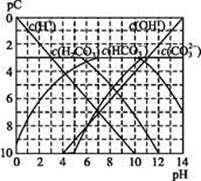
(1)在人体血液中,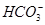 能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
②正常人体血液中,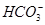 的水解程度 电离程度(填“<”“>”或“=”)。
的水解程度 电离程度(填“<”“>”或“=”)。
③pH=7.00的血液中,c(H2CO3) c(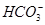 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。
(2)H2CO3一级电离平衡常数的数值 ≈ 。
≈ 。
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的C 不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确。
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确。
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)="0.15" mol·L-1.c( )="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
)="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
炼金废水中含有络离子[Au(CN)2]-,其电离出的CN-有毒,当CN-与H+结合生成HCN时,毒性更强。回答下列问题。
(1)剧毒物HCN的水溶液酸性很弱,写出其电离的方程式: 。
(2)与弱电解质碳酸的电离方式相似,[Au(CN)2]-也存在着两步电离,其一级电离方程式为 。
(3)处理这种废水是在碱性条件下,利用NaClO将CN-氧化为CO32-和N2,其离子方程式为 。在酸性条件下,ClO-也能氧化CN-,但实际处理废水时却不在酸性条件下进行的主要原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com