
| A. | 0.3mol•L-1 | B. | 0.4mol•L-1 | C. | 0.2mol•L-1 | D. | 0.6mol•L-1 |
分析 n(NO)=$\frac{2.24L}{22.4L/mol}$=0.1mol,转移电子物质的量=0.1mol×(5-2)=0.3mol;Cu、Zn分别与稀硝酸反应中生成+2价金属阳离子,则每个金属原子生成金属阳离子时失去2个电子,根据金属和转移电子关系式得[n(Cu)+n(Zn)]=$\frac{1}{2}$n(e-)=$\frac{1}{2}$×0.3mol=0.15mol,溶液中根据电荷守恒得c(NO3-)=c(H+)+2[c(Cu2+)+c(Zn2+)],据此分析解答.
解答 解:n(NO)=$\frac{2.24L}{22.4L/mol}$=0.1mol,转移电子物质的量=0.1mol×(5-2)=0.3mol;Cu、Zn分别与稀硝酸反应中生成+2价金属阳离子,则每个金属原子生成金属阳离子时失去2个电子,根据金属和转移电子关系式得[n(Cu)+n(Zn)]=$\frac{1}{2}$n(e-)=$\frac{1}{2}$×0.3mol=0.15mol,溶液中根据电荷守恒得c(NO3-)=c(H+)+2[c(Cu2+)+c(Zn2+)],结合Cu、Zn原子守恒得c(NO3-)=c(H+)+2[c(Cu2+)+c(Zn2+)]=c(NO3-)=c(H+)+2[c(Cu)+c(Zn)]=0.1mol/L+2×$\frac{0.15mol}{1L}$=0.4mol/L,故选B.
点评 本题考查氧化还原反应方程式的有关计算,为高频考点,明确各个物理量关系是解本题关键,注意原子守恒、转移电子守恒的灵活运用,知道转移电子物质的量等于金属物质的量的关系,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
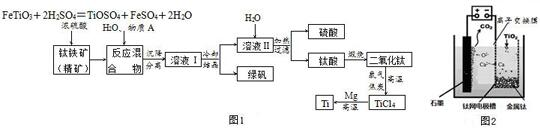
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
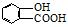 ⑤聚乙烯⑥
⑤聚乙烯⑥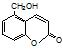 ,⑦丁子香酚
,⑦丁子香酚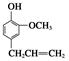
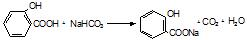 .
.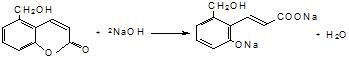 .
.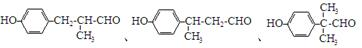 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第三次月考化学卷(解析版) 题型:选择题
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是
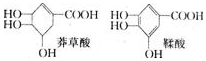
A.等物质的量的两种物质跟足量的NaOH反应,消耗NaOH的量相等
B.完全燃烧等物质的量的两种物质生成二氧化碳和水的量分别相等
C.一定条件下,两种物质都能发生酯化反应和氧化反应
D.鞣酸分子中,可能在同一平面上的原子最多有14个
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
下面是生产生活中的常见有机物的分子式?结构(简)式或名称:
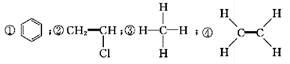
⑤CH3CH2OH;⑥C6H12O6;⑦CH3COOH;⑧硬脂酸甘油酯;⑨蛋白质;⑩聚乙烯。
下列有关说法正确的是( )
A. 能与溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩
B. 投入钠能产生H2的有⑤⑦⑧⑨
C. 属于高分子材料的有⑧⑨⑩
D. 含碳量最高?有毒?常温下为液体且点燃时有浓的黑烟的是①
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
如图为某化学反应速率一时间图。在t1时刻升高温度或增大压强,都符合图所示变化的 反应是 ( )
反应是 ( )
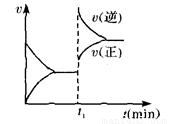
A.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H<0
4NO(g)+6H2O(g) △H<0
B.2SO2(g)+O2(g) 2SO3(g) △H<0
2SO3(g) △H<0
C.H2(g)+I2(g) 2HI(g) △H>0
2HI(g) △H>0
D.C(s)+H2O(g) CO(g)+H2(g) △H>0
CO(g)+H2(g) △H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com