
| A. | 原子半径:X>Y>Z>Q>W | |
| B. | 最高价氧化物对应的水化物的酸性:Z<Q | |
| C. | Q和W可形成原子个数比为1:1和2:1的化合物 | |
| D. | X、Y和W三种元素形成的化合物的水溶液呈碱性 |
分析 Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色反应呈黄色,X为Na元素;W、Z最外层电子数相同,Z的核电荷数是W的2倍,则Z为S,W为O;工业上一般通过电解氧化物的方法获得Y的单质,Y为Al;五种元素核电荷数之和为54,Q的核电荷数为54-8-11-13-16=6,可知Q为C,以此来解答.
解答 解:由上述分析可知,Q为C,W为O,X为Na,Y为Al,Z为S,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:X>Y>Z>Q>W,故A正确;
B.非金属性Z>Q,则最高价氧化物对应的水化物的酸性:Z>Q,故B错误;
C.Q和W可形成原子个数比为1:1和2:1的化合物为CO、CO2,故C正确;
D.X、Y和W三种元素形成的化合物为NaAlO2,水解导致其水溶液呈碱性,故D正确;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、原子结构、元素化合物知识来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
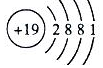

 、
、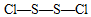 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
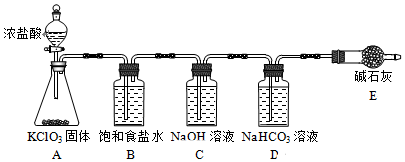
| 实验步骤 | 实验现象 | ||
| B瓶 | C瓶 | D瓶 | |
| 实验1:取样,滴加紫色石蕊溶液 | 变红,不褪色 | 变蓝,不褪色 | 立即褪色 |
| 实验2:取样,测定溶液的pH | 3 | 12 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
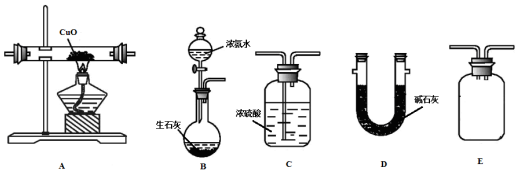
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A. | 元素X的常见化合价是+1价 | |
| B. | 若元素Y处于第3周期,它可与冷水剧烈反应 | |
| C. | 元素X与氯形成化合物时,化学式可能是XCl | |
| D. | 元素Y是ⅢA族的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
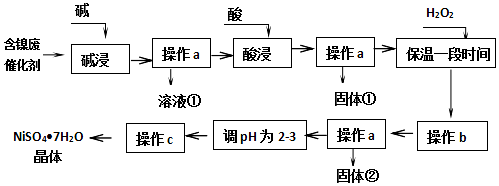
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
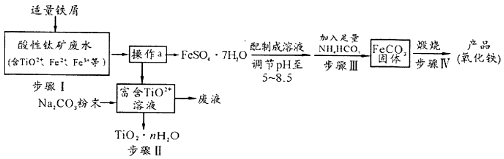
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com