
A��B��C��D��Ԫ�����ڱ�ǰ�����ڳ���������Ԫ�أ�ԭ�������������� ���ǵ���ؽṹ��������Ϣ���±���ʾ�����������Ϣ�������ص����⣺
|
Ԫ�� ��ؽṹ������ A AΪ�ǽ���Ԫ�أ���һ�ֵ����ǵ�������壬���ۡ������������ԣ��������缫���� B �ǵ����ʵ����Ԫ��֮һ��ԭ�Ӻ��������ֲ�ͬ�����ĵ��ӣ���δ�ɶԵ�������� C �䵥�ʼ�����ǿ����ҺӦ������ǿ����Һ��Ӧ����������ڵ������ڵ��������а뾶��С D D�ĸ��Ȼ��������Һ������ӡˢ��·����·�ġ���ʴ�� |
��1��Dλ��Ԫ�����ڱ��� ���ڵ� �壬���̬ԭ�Ӻ���۵����Ų�ʽΪ ��Ԫ��D�ĸ��Ȼ����γɵ�����Һ��ʴӡˢ��·���·��������Ӧ �����ӷ���ʽΪ ��
��2������BԪ���γɵ�Na3B�������� ���壨����ӡ�����ԭ�ӡ��������ӡ����� ����BԪ�ص���̬�⻯�K������ˮ��ԭ������Ϊ���Ǿ��Ǽ��Է���֮�⣬����Ϊ ��
��3��Ԫ��A��Ԫ��B��ȣ��ǽ����Խ�ǿ���� ����Ԫ�ط��ű�ʾ����������Ϊ�ж����߷ǽ�����ǿ�������ݵ��� ��
a��������A�ĵ��ʺ�B�ĵ���״̬��ͬ
b��������ԭ���γɵĹ��ۼ��й��õ��ӶԵ�ƫ��
c������������Ӧˮ���������ǿ��
d���������ᷴӦ�����׳̶�
��4����֪��5.4gԪ��C�ĵ��ʿ���Ԫ��D�ĵͼ������ﷴӦ���ų�346.2kJ����������д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��1�� �� (1��) �� ��1�֣� 3d64s2 ��2�֣� 2Fe3++Cu = 2 Fe2+ + Cu2+ (2��)
��2������ ��2�֣� NH3��H2O���Ӽ�����γ���� ��2�֣�
��3�� N ��1�֣� b c (2��)
��4��2Al(s) +3FeO(s) = Al2O3(s) + 3Fe (s) ��H = -3462 kJ/mol (3��)
��������
����������������Ϣ��֪��A��B��C��D�ֱ�ΪC��N��Al��Fe��
��1��Feλ�����ڱ��������ڣ��ڢ��壬�۵����Ų�ʽΪ3d64s2��
��2��Na3NΪ���Ӿ��壻NH3������ˮ��Ҫԭ���ǿ�����ˮ�����γ������
��3��a���ǽ�����ǿ���뵥��״̬�أ�����
b���ǽ�����ǿ�ĶԵ��ӶԵ������������õ��Ӷ���ƫ���Ԫ�أ���ȷ
c������������Ӧˮ���������Խǿ��ǽ�����Խǿ����ȷ
d���ǽ�����ǿ�����ᷴӦ�����أ�����
��4���Ȼ�ѧ��Ӧ����ʽ����д��ע�����ʵ�״̬��
���㣺���⿼����Ԫ�ص��ƶϣ���������Ų�ʽ��д���Ȼ�ѧ��Ӧ����ʽ����д���ǽ���ǿ�����жϵ�֪ʶ���ѶȲ���


 �¿α�������������ҵ�������γ�����ϵ�д�
�¿α�������������ҵ�������γ�����ϵ�д� ����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�� | A | B | C | D |
| ���� �ṹ ��Ϣ |
������������ȼ�ջ���ʻ�ɫ�������������̣����ò������������E���� ���ӵ�������ͬ�� |
�����Ǵ��н�������ĻҺ�ɫ���壬����Ϣ������ �ؼ����ϣ� |
����������ˮ����������̬�⻯�ﷴӦ�õ����ӻ�����E�� | ��������һ���ͻ���ϣ�������A������������ˮ����� ��������F�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
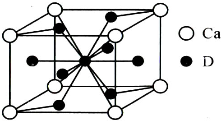 ��5�������Ͻ��������Ͻ�����ͬ���͵ľ����ṹXYn�������к�ǿ�Ĵ�����������֪�����Ͻ�LaNin�������Ϊ9.0��10-23 cm3��������γ�LaNinH4.5�Ͻ�����뾧����϶��������䣩����LaNin��n=
��5�������Ͻ��������Ͻ�����ͬ���͵ľ����ṹXYn�������к�ǿ�Ĵ�����������֪�����Ͻ�LaNin�������Ϊ9.0��10-23 cm3��������γ�LaNinH4.5�Ͻ�����뾧����϶��������䣩����LaNin��n=�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�� | A | B | C | D |
| ���ʽṹ��Ϣ | ������������ȼ�ջ���ʻ�ɫ�������������̣����ò������������E�������ӵ�������ͬ�� | �����Ǵ��н�������ĻҺ�ɫ���壬����Ϣ�����Ĺؼ����ϣ� | ����������ˮ����������̬�⻯�ﷴӦ�õ����ӻ�����E�� | ��������һ���ͻ���ϣ�������A������������ˮ����õ�F�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ������ʡ��УЭ��������ڶ�������ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ������
����������������10��1�յ�Լ19ʱ26�֣��϶���������ɹ����䡣����Щʱ������������9ʱ�𣬹�����Ա��ʼΪ���϶���š��ͳ����������ע����ȼ�ϣ���14ʱ30�����Ҽ�ע����ȼ�ռ����˺���18ʱ���Ҽ�ע��������


�ף��϶���ŷ���˲�� �ң������е��϶����
��֪A��B��C��D��Ԫ�����ڱ��е����ֶ�����Ԫ�أ���ԭ��������������A�ĵ��������������еġ�ȼ�ռ�����C�ĵ��������������еġ�����������AԪ��ԭ����û�����ӣ�bB��cC����Ԫ�ش��ڹ�ϵ��b = c��1��CԪ�س������ϼ۵ľ���ֵ����������������ͬ����B��C���γɶ�����̬���������һ�ֿ����ڴ���Ȼ״̬���γɣ�A��D����Ԫ���γɵ�˫ԭ�ӷ��ӵ�ˮ��Һ�ǹ�ҵ����ǿ��֮һ��
�����������⣺
��1��AԪ����Ԫ�����ڱ��� ���У�DԪ����Ԫ�����ڱ��� �����С�
��2��Bԭ�ӵ�ԭ�ӽṹʾ��ͼ�� ��
��3��A��B����Ԫ���γɵ���ԭ�ӷ��ӵĵ���ʽΪ ��
��4����ͼ���з�����Ӧ�Ļ�ѧ����ʽΪ�� ��
��5��A��B�γɵ���ԭ�ӷ���BA2��BA2Ҳ������Ϊ��������е�ȼ�ռ�����ʱ����ʹ��A��C�γɵ���ԭ�ӷ��ӣ�A2C2����Ϊ����������֪8g BA2��BA2������A2C2��Ӧ���������Ϊ�����壬�ų�����Ϊ160.35kJ��
��д��������Ӧ���Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012���ս̰���л�ѧ����2 1.2��֮������������ϰ���������棩 ���ͣ������
A��B��C��D��Ԫ�����ڱ���ǰ�������������Ԫ�أ�A����D���AD2�ͻ����AD2�к������������30������D���ĺ�������Ų���Al3+��ͬ��B��C�����γ�BC�ͻ����BC����������������18��BCˮ��Һ��һ��ǿ�ᣬ�Իش�
��1��д����������Ԫ�ص����ƣ�A______��B______��C______��D______��
��2��д��AD2�ĵ���ʽ ��__________�����ڡ�
��3��D������ˮ��Ӧ�Ļ�ѧ����ʽΪ_________________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com