


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
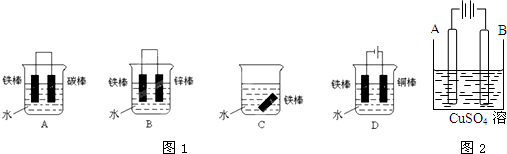
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内气体密度不随时间变化 |
| B、v正(X):v逆(Y)=l:2 |
| C、容器内X、Y、Z的浓度之比为1:2:2 |
| D、单位时间消耗0.1 mol X同时生成0.2mol Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度 |
| B、增大密闭容器的容积 |
| C、使用催化剂 |
| D、增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeO固体放入稀硝酸溶液中:FeO+2H+═Fe2++H2O |
| B、过量的铁粉与稀硝酸溶液反应:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| C、向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
| D、向Fe(OH)3中加入氢碘酸:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNH4+和1molOH-所含电子数均为10NA |
| B、14gC2H4和14gC3H6 所含原子数均为3NA |
| C、1L l mol/LH2SO4溶液与Zn反应生成22.4L |
| D、标准状况下,11.2LSO3所含分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com