
【题目】化合物H[3-亚甲基异苯并呋喃-1(3H)-酮]的一种合成路线如下:
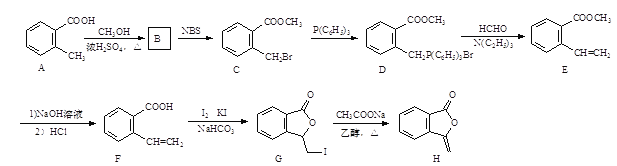
(1)C中所含官能团名称为_________和_________。
(2)G生成H的反应类型是________。
(3)B的分子式为C9H10O2,写出B的结构简式:________。
(4)E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_________。①分子中含有苯环,能使Br2的CCl4溶液褪色;
②碱性条件水解生成两种产物,酸化后分子中均只有4种不同化学环境的氢,其中之一能与FeCl3溶液发生显色反应。
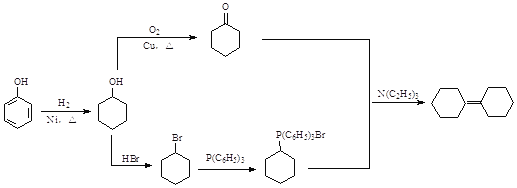
(5)写出以![]() 、P(C6H5)3及N(C2H5)3为原料制备
、P(C6H5)3及N(C2H5)3为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)____。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)____。
【答案】酯基 溴原子 消去反应 
![]() 或
或
【解析】
(1)根据C的结构简式 判断其官能团;
判断其官能团;
(2)根据G、H分子结构的区别判断反应类型;
(3)A是邻甲基苯甲酸,A与甲醇在浓硫酸存在条件下加热,发生酯化反应产生B;
(4)根据同分异构体的概念及E的结构简式和对其同分异构体的要求可得相应的物质的结构简式;
(5)苯酚与氢气发生加成反应产生环己醇,环己醇一部分被催化氧化产生环己酮,另一部分与HBr发生取代反应产生1-溴环己烷,1-溴环己烷发生题干信息反应产生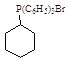 ,
,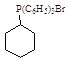 与环己酮发生信息反应得到目标产物。
与环己酮发生信息反应得到目标产物。
(1)由C结构简式 可知其含有的官能团名称是酯基、溴原子;
可知其含有的官能团名称是酯基、溴原子;
(2)由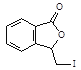 与
与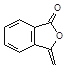 分析可知:G与CH3COONa在乙醇存在时加热,发生消去反应产生
分析可知:G与CH3COONa在乙醇存在时加热,发生消去反应产生 和HI;
和HI;
(3)A是邻甲基苯甲酸,A与甲醇在浓硫酸存在条件下加热,发生酯化反应产生B;是邻甲基苯甲酸甲酯,结构简式是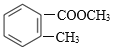 ;
;
(4)E结构简式为: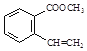 ,其同分异构体要求:①分子中含有苯环,能使Br2的CCl4溶液褪色,说明含有不饱和的碳碳双键;
,其同分异构体要求:①分子中含有苯环,能使Br2的CCl4溶液褪色,说明含有不饱和的碳碳双键;
②碱性条件水解生成两种产物,酸化后分子中均只有4种不同化学环境的氢,其中之一能与FeCl3溶液发生显色反应,说明是苯酚与酸形成了酯;则该物质可能为![]() 或
或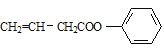 ;
;
(5)苯酚与氢气在Ni催化下,加热,发生加成反应产生环己醇![]() ,环己醇一部分被催化氧化产生环己酮
,环己醇一部分被催化氧化产生环己酮![]() ,另一部分与HBr发生取代反应产生1-溴环己烷
,另一部分与HBr发生取代反应产生1-溴环己烷![]() ,1-溴环己烷与P(C6H5)3发生题干信息反应产生
,1-溴环己烷与P(C6H5)3发生题干信息反应产生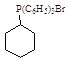 ,
,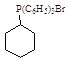 与
与![]() 在N(C2H5)3发生信息反应到目标产物
在N(C2H5)3发生信息反应到目标产物![]() 。所以由
。所以由![]() 合成
合成![]() 路线流程图为:
路线流程图为: 。
。


科目:高中化学 来源: 题型:
【题目】根据所学知识回答下列问题。
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的![]() 和
和![]() 单质燃烧时均放出大量热,可用作燃料.已知
单质燃烧时均放出大量热,可用作燃料.已知![]() 和
和![]() 为短周期元素,其原子的第一至第四电离能如下表所示:
为短周期元素,其原子的第一至第四电离能如下表所示:
电离能/ |
|
|
|
|
| 932 | 1821 | 15390 | 21771 |
| 738 | 1451 | 7733 | 10540 |
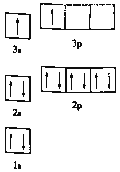
①某同学根据上述信息,推断![]() 的核外电子排布如图所示,该同学所画的电子排布图违背了_________,
的核外电子排布如图所示,该同学所画的电子排布图违背了_________, ![]() 元素位于周期表五个区域中的___ 区。
元素位于周期表五个区域中的___ 区。
②![]() 分子的中心原子
分子的中心原子![]() 采取_________杂化,
采取_________杂化, ![]() 的空间构型为___ 。
的空间构型为___ 。
(2)![]() 原子或离子外围有较多能量相近的空轨道,所以其能与一些分子或离子形成配合物。
原子或离子外围有较多能量相近的空轨道,所以其能与一些分子或离子形成配合物。
① 与![]() 原子或离子形成配合物的分子或离子应具备的结构特征是____。
原子或离子形成配合物的分子或离子应具备的结构特征是____。
② 六氰合亚铁离子![]() 中不存在____________(填字母)。
中不存在____________(填字母)。
A.共价键 B.非极性键 C.配位键 D. ![]() 键
键
写出一种与![]() 互为等电子体的单质的分子式:________________ 。
互为等电子体的单质的分子式:________________ 。
(3)—种![]() 合金的晶胞结构如图,请据此回答下列问题:
合金的晶胞结构如图,请据此回答下列问题:
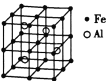
① 该合金的化学式为____________。
② 若晶体的密度为![]()
![]() ,则该晶胞棱长为____________
,则该晶胞棱长为____________![]() (设
(设![]() 为阿伏加德罗常数的值,用含
为阿伏加德罗常数的值,用含![]() 和
和![]() 的代数式表示,不必化简)。
的代数式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 浓度均为
浓度均为![]() 和
和![]() 的混合溶液中滴加
的混合溶液中滴加![]() 的
的![]() ,测得混合溶液的电阻率(溶液的电阻率越大,导电能力越弱)与加入氨水的体积
,测得混合溶液的电阻率(溶液的电阻率越大,导电能力越弱)与加入氨水的体积![]() 的关系如图所示(忽略混合时体积变化),下列说法正确的是( )
的关系如图所示(忽略混合时体积变化),下列说法正确的是( )

A.常温下,![]() 的
的![]() 比同浓度
比同浓度![]() 的
的![]() 大
大
B.![]() 过程中水的电离程度先减小后增大
过程中水的电离程度先减小后增大
C.![]() 点溶液中,
点溶液中,![]()
D.![]() 点时,
点时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美托洛尔可用于治疗高血压及心绞痛,某合成路线如图:
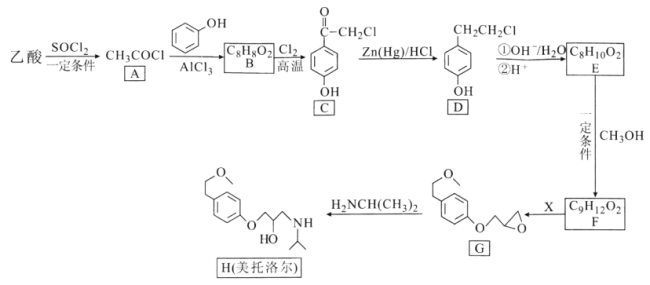
回答下列问题:
(1)已知常温下,![]() (氯化亚砜)是一种有强烈刺激气味发烟液体,遇水水解,加热分解。下列关于乙酸制备A的实验表述正确的是__________(填字母序号)。
(氯化亚砜)是一种有强烈刺激气味发烟液体,遇水水解,加热分解。下列关于乙酸制备A的实验表述正确的是__________(填字母序号)。
a.该实验常采用浓的醋酸溶液与过量![]() 反应以提高产率
反应以提高产率
b.反应控制在较高温度下,并加入催化剂加快反应速率
c.反应产物中有污染性气体,需在通风厨中进行,且要吸收尾气
d.该反应有机副产物少、产品易分离,且产率较高。
(2)C中含氧官能团的名称是__________。
(3)A→B的反应类型是__________,D的分子式为__________。
(4)反应E→F的化学方程式为__________。
(5)试剂X的分子式为![]() ,则X的结构简式为__________,X的同分异构体中含
,则X的结构简式为__________,X的同分异构体中含![]() 的有__________种。
的有__________种。
(6)4-苄基苯酚(![]() )是一种药物中间体,请设计以苯甲酸和苯酚为原料制备4-苄基苯酚的合成路线:__________(无机试剂任用)。
)是一种药物中间体,请设计以苯甲酸和苯酚为原料制备4-苄基苯酚的合成路线:__________(无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水提取镁和溴的流程如图,请回答相关问题。
(1)从海水中提取镁的流程如图所示(框图中是主要产物):
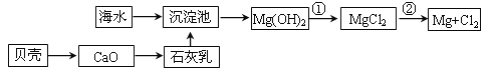
i.反应①的离子方程是_____;
ii.反应②的化学方程式是_____。
(2)从海水中提取溴的流程如图所示(框图中是主要产物):
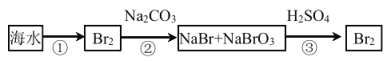
i.过程②中,向混合液中吹入热空气,将溴吹出,用纯碱吸收,吹入热空气的目的是______。
ii.过程③中反应的化学方程式是______。
iii.若最终得到的溴单质中仍然混有少量的Cl2,则除去该杂质的方法是______。(结合离子方程式回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池是低成本高效电池。该电池通过一种复杂的铜“腐蚀”现象产生电能,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-。下列说法不正确的是
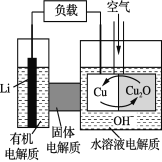
A. 放电时,Li+透过固体电解质向Cu极移动
B. 通空气时,铜被腐蚀,产生Cu2O
C. 放电时,正极的电极反应式为:Cu2O+2H+ +2 e- ===2Cu+H2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为元素周期表中前四周期元素,原子序数依次增大,A元素原子核外有3个未成对电子,B元素原子核外电子占用3个能级,其中最高能级上的电子数是其所在能层数的2倍,D元素与B元素同族,C元素与A元素同族,E元素原子的价电子数是其余电子数的一半。
(1)A、C、D的第一电离能由大到小的顺序为___________________(用元素符号表示),E2+的基态电子排布式为__________________________________。
(2)B和D的氢化物中,B的氢化物沸点较高的原因是____________________________。
(3)C形成的最高价氧化物的结构如图所示,该结构中C-B键的键长有两类,键长较短的键为__________(填“a”或“b”)。
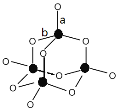
(4)E可与CO形成羰基配合物E2(CO)8,是有机合成的重要催化剂,不溶于水,溶于乙醇、乙醚、苯,熔点50~51℃,45℃(1.33kPa)时升华。
① E2(CO)8为_________晶体。(填晶体类型)
② E2(CO)8晶体中存在的作用力有______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应:AsO33(aq)+I2(aq)+2OH![]() AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。
AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.v(I)=2v(AsO33)
c. c (AsO43)/c (AsO33)不再变化
d. c(I)=y mol·L1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com