
| A. | 烧杯 | B. | 玻璃棒 | C. | 容量瓶 | D. | 分液漏斗 |
科目:高中化学 来源: 题型:解答题
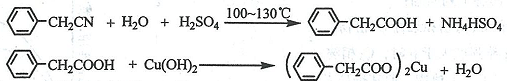
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
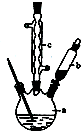
| A. | CH3OH的燃烧热为192.9 kJ/mol | |
| B. | CH3OH转变成H2的过程不一定要吸收能量 | |
| C. | 根据①②推知反应:H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+241.9 kJ/mol | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
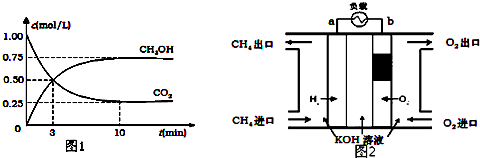
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al→[Al(OH)4]- | B. | Na2CO3→NaOH | C. | Al2O3→Al(OH)3 | D. | Fe(OH)2→Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | 铁锅生锈的正极反应为:O2+2H2O+4e-═4OH- | |
| D. | 工业上电解饱和食盐水的阳极反应为:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂和还原剂的物质的量比为8:3 | |
| B. | 被还原的HNO3和起酸性作用的HNO3的物质的量的比为2:3 | |
| C. | 生成1molNO气体转移的电子数为3NA | |
| D. | 该反应中Cu(NO3)2 为氧化产物,H2O为还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
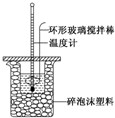 某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1 硫酸溶液进行反应热的测定,实验装置如图所示.
某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1 硫酸溶液进行反应热的测定,实验装置如图所示.| 温度 次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com