
【题目】下列叙述中正确的是( )
A.若烃中碳、氢元素的质量分数相同,则为同系物
B.CH2═CH2和CH2═CH﹣CH═CH2互为同系物
C.![]() 和
和 ![]() 互为同分异构体
互为同分异构体
D.同分异构体的化学性质可能相似
【答案】D
【解析】A.同系物中碳、氢元素的质量分数不一定对应相同,如甲烷与乙烷.烃中碳、氢元素的质量分数对应相同,不一定是同系物如乙炔与苯,A不符合题意;
B.CH2═CH2和CH2═CH﹣CH═CH2碳碳双键的个数不同,不为同系物,B不符合题意;
C. ![]() 和
和 ![]() 分子式不同,C不符合题意;
分子式不同,C不符合题意;
D.互为同分异构体的两种有机物的物理性质有差别,化学性质可能相似,如正丙烷和异丙烷;也可能不同,如乙酸与甲酸甲酯性质不同,D符合题意.
所以答案是:D。
【考点精析】关于本题考查的芳香烃、烃基和同系物,需要了解分子里含有一个或多个苯环的碳氢化合物,称为芳香烃,其中由一个苯环和饱和烃基组成的芳香烃叫苯的同系物,其通式为CnH2n–6(n≥6)才能得出正确答案.


科目:高中化学 来源: 题型:
【题目】5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.
阳离子 | Na+ Al3+Fe3+ Cu2+、Ba2+ |
阴离子 | OH﹣ Cl﹣ CO32﹣ NO3﹣ SO4﹣ |
分别取它们的水溶液进行实验,结果如下:①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3 , 沉淀部分溶解,剩余白色固体;②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6molL﹣1稀H2SO4 , Cu逐渐溶解,管口附近有红棕色气体出现.
(1)据此推断A、C的化学式为:A;C .
(2)写出步骤②中发生反应的化学方程式 .
(3)D溶液中滴入石蕊试液,现象是 , 原因是(用离子方程式说明).
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是mL.
(5)现用500mL 3molL﹣1的E溶液充分吸收11.2L CO2气体(标准状况 下),反应后溶液中各离子的物质量浓度由小到大的顺序为 .
(6)若用惰性电极电解A和B的混合溶液,溶质的物质的量均为0.1mol,请在坐标系中画出通电后阳极产生气体的体积(标准状况下)V与通过电子的物质的量n的关系(不考虑气体溶于水).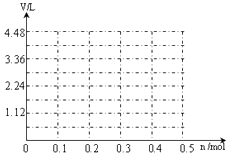
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.1.0 molL﹣1KNO3溶液:H+、Fe2+、SCN﹣、SO42﹣
B.![]() 的溶液:K+、Ba2+、NO3﹣、Cl﹣
的溶液:K+、Ba2+、NO3﹣、Cl﹣
C.pH=0的溶液:Al3+、Cl﹣、SO42﹣、CO32﹣
D.c(ClO﹣)=1.0 molL﹣1的溶液:Na+、I﹣、S2﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、磷、硫元素的单质和化合物应用广泛.
(1)磷元素的原子结构示意图是 .
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2═6CaSiO3+P4O10 10C+P4O10═P4+10CO
每生成1mol P4时,就有mol电子发生转移.
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:
C6H8O6+I2═C6H6O6+2H++2I﹣ 2S2O32﹣+I2═S4O62﹣+2I﹣
在一定体积的某维生素C溶液中加入a molL﹣1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2 , 消耗b molL﹣1Na2S2O3溶液V2mL.该溶液中维生素C的物质的量是mol.
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3﹣+5SO32﹣+2H+═I2+5SO42﹣+H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如表所示:
0.01molL﹣1 | 0.01molL﹣1 | H2O的体积 | 实验 | 溶液出现蓝色时所需时间/s | |
实验1 | 5 | V1 | 35 | 25 | |
实验2 | 5 | 5 | 40 | 25 | |
实验3 | 5 | 5 | V2 | 0 |
该实验的目的是;表中V2=mL
(5)Ⅱ、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl36H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是 .
(6)在某强酸性混合稀土溶液中加入H2O2 , 调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:Ce3++H2O2+H2O═Ce(OH)4↓+ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,按单质、化合物、混合物顺序排列的是( )
A. 铁、四氧化三铁、冰水混合物 B. 金属钙、生石灰、碱石灰
C. 水银、空气、干冰 D. 二氧化硫、水蒸气、天然气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗定律成立的根本原因是在一定温度和压强下 ( )
A.气体体积的大小只随分子数量的多少而变化
B.不同气体分子的大小几乎相等
C.不同气体分子间的平均距离几乎相等
D.气体分子间的平均距离与分子本身的大小成正比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在呼吸面具和潜水艇中可用过氧化钠作供氧剂。请选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。
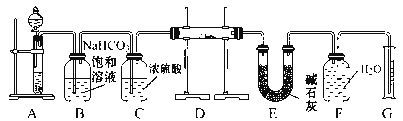
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:____________________。
(2)B、C、E均为除杂装置(U型管中加固体干燥剂)除杂顺序如表:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | _________ |
C | 浓硫酸 | _________ |
E | 碱石灰 | _________ |
(3)写出B中发生反应的离子方程式:__________________________________。
(4)写出D中过氧化钠与二氧化碳反应的化学方程式:__________________。
(5)试管F中收集满气体后,证明试管中收集的气体是氧气的实验操作是:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na2SO4、K2SO4、KCl的混和溶液中,如果c(Cl-)=0.1mol/L,c(Na+)=0.2mol/L,c(SO42-)=xmol/L,c(K+)=ymol/L,则x和y的关系是( )
A. x=0.5y B. 2x=0.1+y C. y=2(x-0.1) D. y=2x+0.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学知识,请你回答下列问题:
(1)最外层电子排布为4s24p1的原子的核电荷数为 . 某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4 , 该元素的名称是 .
(2)根据VSEPR模型,PO43﹣的分子立体结构为:;乙醇易溶于水的原因是;HClO4的酸性强于HClO的原因是;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体为 .
(4)某元素核外有三个电子层,最外层电子数是核外电子总数的 ![]() ,写出该元素原子的电子排布式是 . 写出铬元素在周期表中的位置 , 它位于区.
,写出该元素原子的电子排布式是 . 写出铬元素在周期表中的位置 , 它位于区.
(5)如图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为a pm,氯化铯(CsCl)的相对分子质量M,NA为阿伏伽德罗常数,则氯化铯晶体的密度为g/cm3 . 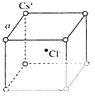
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com