
【题目】氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为 。
(2)反应2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) 在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
CO(NH2)2(s)+H2O(g) 在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。

图1 图2 图3
①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.61
生产中应选用水碳比的数值为 (选填序号)。
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是 。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)= (空气中氧气的体积含量大约为20%)。
②图2是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为 %。
(4)图3表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式 。生产中可分离出的物质A的化学式为 。
【答案】(1)+72.49(1分)
(2)①A(1分)②氨碳比在4.5时,NH3的量增大较多,而CO2的转化率增加不大,提高了生产成本(1分)
(3)①1∶1(2分)②5(±0.2)%(1分)
(4)N2+6e—+8H+=2NH4+ (1分) NH4Cl(1分)
【解析】
试题分析:
(1)根据盖斯定律,方程式③=②+①,反应热也进行相应运算,求得a为+72.49;
(2)①水碳比的数值在 0.6~0.7 范围进转化率提升更快,所以选A;②由图像分析可以看出,氨碳比在4.5时,NH3的量增大较多,而CO2的转化率增加不大,提高了生产成本,不符合经济效益。
(3)①烟气中V(NO)∶V(NO2)=5∶1,假设NO为5mol,那么NO2为1 mol,根据NO+NO2+H2O=2HNO2 这个反应,只有两者物质的量相同时才能完全被吸收,这时需要O2,根据2NO+ O2=2NO2,可知应该有2molNO参加反应生成2mol NO2,这个过程需要O21 mol,而空气中氧气的体积含量大约为20%,要提供O21 mol需要空气物质的量为5mol,所以V(NO)∶V(空气)=1∶1②由图像可以看出当尿素浓度在5左右时转化率已经比较高了,如果浓度再增大时转化率提高不明显,所以答案填5(±0.2)%都算正确。
(4)根据氧化还原反应原理,由于N2、H2为电极反应物,正极反应元素化合价应该降低,得到电子,首先确定N2参与正极反应,再根据电解质溶液情况产物应该为NH4+,从电子守恒和电荷守恒及原子个数守恒三个角度可以确定其电极反应式为N2+6e—+8H+=2NH4+, 由于电池工作中有NH4Cl生成,所以生产中可分离出的物质为NH4Cl。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】“信息”“材料”和“能源”被称为新科技革命的三大支柱。下列有关信息错误的是
A. 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B. 目前中、美、日等国掌握的陶瓷发动机技术,大大提高了发动机的能量转化效率
C. 载人飞船使用了大量的复合材料
D. 合成高分子材料的广泛应用是有百利而无一害的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明缺硒可导致克山病。克山病是一种地方性心肌病,急重症病人可发生猝死。营养学和流行病学界专家认为,成人每天硒的摄取量约在40~100 μg就可满足人体需要。根据资料,下列解释不正确的是( )
A. 硒是人体必需的化学元素
B. 硒在人体生长发育过程中的作用不可替代
C. 硒的作用重大,只要有了硒,人体就能正常生长发育
D. 硒是人体必需的微量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是玉米植株和成人体内含量较多的化学元素的种类和含量:
元素 | O | C | H | N | K | Ca | P | Mg | S |
玉米 | 44.43 | 43.57 | 6.24 | 1.46 | 0.92 | 0.23 | 0.20 | 0.18 | 0.17 |
人 | 14.62 | 55.99 | 7.46 | 9.33 | 1.09 | 4.67 | 3.11 | 0.16 | 0.78 |
比较这两者所含的化学元素
A. 种类和含量都相差很大
B. 种类和含量都相差不大
C. 种类相差很大,其中相同元素的含量都大体相同
D. 种类大体相同,其中相同元素的含量相差很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素在生物体内虽然含量很少,却是维持正常生命活动不可缺少的。该观点可以通过下面哪一实例得到证明?( )
A. 缺Mg时叶片变黄 B. 油菜缺少B时只开花不结果
C. 动物血液钙盐含量太低会抽搐 D. 缺P会影响ATP的吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为合成氨N2(g)+3H2(g)![]() 2NH3(g)反应过程中的能量变化情况,请回答下列问题:
2NH3(g)反应过程中的能量变化情况,请回答下列问题:
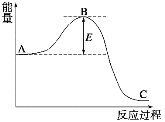
(1)反应中用活性铁作催化剂,使用活性铁会使图中B点升高还是降低________,理由是___________。
(2)该反应平衡常数为K,当浓度商Qc______K(填“<”、“>”或“=”)时,反应向右进行。
(3)400 ℃时该反应的平衡常数_______450 ℃时的平衡常数(填“<”、“>”或“=”)。
(4)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,可以采取的合理措施有(填字母)________。
A.高温高压
B.加入催化剂
C.增加N2的浓度
D.增加H2的浓度
E.分离出NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性KMnO4溶液与H2C2O4溶液的反应通常用来研究浓度对反应速率的影响。现有甲、乙两个实验小组设计不同的实验方案如下:
甲组:改变反应物的浓度,通过溶液褪色的时间来比较反应速率快慢。
可以使用的试剂有:① 0.01mol/L KMnO4酸性溶液、② 0.02mol/L KMnO4酸性溶液、③ 0.1 mol/L H2C2O4溶液、④ 0.2 mol/L H2C2O4溶液。
(1)酸性KMnO4溶液与H2C2O4溶液反应的离子方程式为:__________________________;
(2)请从上面的四种溶液中选择本实验所需的三种溶液(填写序号)_______________;
(3)问题讨论:已知该实验过程中溶液温度几乎不变,但是依据实验数据发现开始一段时间后速率却在增大。
①你认为引起该反应速率增大的因素是_____________________。
②欲设计实验确认,请完成以下设计表a、b、c(褪色时间不需填写):
实验 编号 | 0.01mol/LKMnO4酸性溶液/mL | 0.2mol/L H2C2O4溶液/mL | MnSO4 固体/g | 褪色 时间/s |
1 | 4mL | 2 mL | a | |
2 | b | c | 0.2 g |
乙组:通过测定不同浓度的溶液生成CO2气体体积的方法来比较化学反应速率的大小。
实验装置如图,实验时分液漏斗中A溶液一次性放入B溶液中

已知乙组完成两次实验分别是Ⅰ、Ⅱ。请完成以下各空:
(4)如何检查该装置的气密性:___________________。
(5)分析所给实验仪器,实现该实验目的还欠缺的仪器:_________________。你将如何比较Ⅰ、Ⅱ化学反应速率大小?你的操作是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+3B(g)=2C(g)+5D(g)在四种不同条件下的反应速率分别为:
① v(A)=0.8 mol·L-1·min-1 ② v(B)=0.6 mol·L-1·min-1
③ v(C)=0.3mol·L-1·min-1 ④ v(D)=1.2 mol·L-1·min-1
表示该反应速率最慢的是
A.① B.② C.③ D.④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com