
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
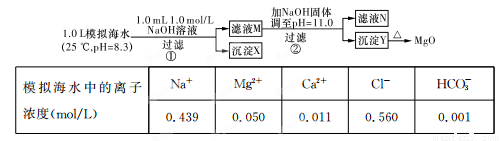
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。已知:KSp(CaCO3)=4.96×10-9;KSp(MgCO3)=6.82×10-6;KSp[Ca(OH)2]=4.68×10-6;KSp[Mg(OH)2]=5.61×10 -12。
下列说法不正确的是
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+和Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y只有Mg(OH)2
C
【解析】
试题分析:步骤①,从题给的条件,可知n(NaOH)=0.001mol,[即n(OH-)=0.001mol].依据离子反应“先中和、后沉淀、再其他”的反应规律,当1L模拟海水中,加入0.001mol NaOH时,OH- 恰好与HCO3-完全反应:OH-+HCO3- CO32-+H2O,生成0.001molCO32-.由于Ksp(CaCO3)<<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3 沉淀Ca2++CO32-=CaCO3↓.所以沉淀物X为CaCO3,故A正确;步骤①中,由于CO32-只有0.001mol,反应生成CaCO3 所消耗的Ca2+也只有0.001mol,滤液中还剩余c(Ca2+)=0.010mol·L-1,所以滤液M中同时存在着Ca2+和Mg2+,故B正确;步骤②,当滤液M中加入NaOH 固体,调至pH=11时,此时滤液中c(OH-)=1×10-3 mol·L-1.则Q[Ca(OH)2]=c(Ca2+)×(10-3)2=0.010×(10-3)2=10-8<Ksp[Ca(OH)2],无Ca(OH)2生成,Q[Mg(OH)2]=c(Mg2+)×(10-3)2=0.050×(10-3)2=5×10-8>Ksp[Mg(OH)2],有Mg(OH)2沉淀生成,又由于Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6<10-5,无剩余,滤液N中不存在Mg2+,故C错误;步骤②中若改为加入4.2 g NaOH固体,则n(NaOH)=0.105mol,与0.05mol Mg2+反应:Mg2++2OH-=Mg(OH)2↓,生成0.05 molMg(OH)2,剩余0.005 mol OH-,由于Q[Ca(OH)2]=c(Ca2+)×(OH-)2=0.010×(0.005)2=2.5×10-7<Ksp[Ca(OH)2],所以无Ca(OH)2沉淀析出,沉淀物Y为Mg(OH)2沉淀,故D正确。
CO32-+H2O,生成0.001molCO32-.由于Ksp(CaCO3)<<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3 沉淀Ca2++CO32-=CaCO3↓.所以沉淀物X为CaCO3,故A正确;步骤①中,由于CO32-只有0.001mol,反应生成CaCO3 所消耗的Ca2+也只有0.001mol,滤液中还剩余c(Ca2+)=0.010mol·L-1,所以滤液M中同时存在着Ca2+和Mg2+,故B正确;步骤②,当滤液M中加入NaOH 固体,调至pH=11时,此时滤液中c(OH-)=1×10-3 mol·L-1.则Q[Ca(OH)2]=c(Ca2+)×(10-3)2=0.010×(10-3)2=10-8<Ksp[Ca(OH)2],无Ca(OH)2生成,Q[Mg(OH)2]=c(Mg2+)×(10-3)2=0.050×(10-3)2=5×10-8>Ksp[Mg(OH)2],有Mg(OH)2沉淀生成,又由于Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6<10-5,无剩余,滤液N中不存在Mg2+,故C错误;步骤②中若改为加入4.2 g NaOH固体,则n(NaOH)=0.105mol,与0.05mol Mg2+反应:Mg2++2OH-=Mg(OH)2↓,生成0.05 molMg(OH)2,剩余0.005 mol OH-,由于Q[Ca(OH)2]=c(Ca2+)×(OH-)2=0.010×(0.005)2=2.5×10-7<Ksp[Ca(OH)2],所以无Ca(OH)2沉淀析出,沉淀物Y为Mg(OH)2沉淀,故D正确。
考点:考查考查了Ksp的应用和计算,离子反应等。


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
(2011?浙江)海水中含有丰富的镁资源.某同学设计了从模拟海水中制备MgO的实验方案: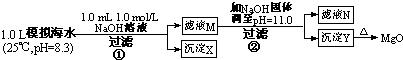
|
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中含有丰富的镁资源.某同学设计了从模拟海水中制备Mg0的实验方案( )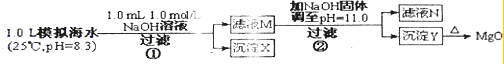
已知:Kap[Mg(OH)4]=5.61×10-12 下列说法正确的是( ) |
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中含有丰富的镁资源.某同学设计了从模拟海水中制备MgO的实验方案:
 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年云南省部分名校高三第一次联考(11月)理综化学试卷(解析版) 题型:填空题
海水中含有丰富的镁资源。工业上常用海水晒盐后的苦卤水提取Mg,流程如下图所示:
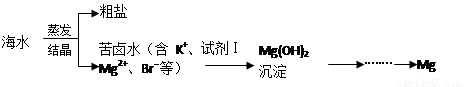
(1)工业制取镁的方法是 法。
(2)试剂Ⅰ一般选用 (填化学式)。
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。
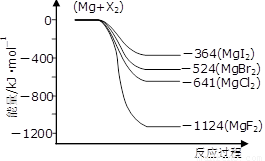
①由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应;推测化合物的热稳定性顺序为MgI2 MgF2(填“>”、“=”或“<”)。
②依上图数据写出MgBr2(s)与Cl2(g)反应的热化学方程式 。
(4)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体生成。写出CH3MgCl水解的化学方程式 。
(5)向Mg(OH)2中加入NH4Cl溶液,可使沉淀溶解,请结合平衡原理和必要的文字解释原因 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省高三第二次月考化学试卷 题型:选择题
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
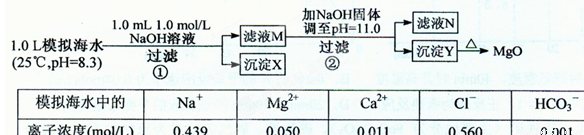
注:溶液中某种离子的浓度小于1.0×10-5mo1/L,可认为该离子不存在;
已知:Ksp(CaCO3)= 4.96×10-9; Ksp(MgCO3)= 6.82× 10-6;
Ksp[Ca(OH)2]=4.68×l0-6; Ksp[Mg(OH)2]=5.61×l0-12。
下列说法正确的是(假设实验过程中溶液体积不变) ( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com