
����Ŀ��������ˮ�п��ܴ��ڵ���ƽ�⡢�ε�ˮ��ƽ��ͳ������ܽ�ƽ�⣬���Ƕ��ɿ�����ѧƽ�⡣�����µ�A~G�������ѧ֪ʶ�ش�
(1)AΪ0.1 mol��L��1��(NH4)2SO4��Һ��ʵ����A��pH<7��ԭ����(�����ӷ���ʽ��ʾ)�� ���ڸ���Һ�и�������Ũ���ɴ�С��˳��Ϊ_______________��
(2)BΪ0.1 mol��L��1 NaHCO3��Һ��ʵ����B��pH>7�������B�Լ��Ե�ԭ�� ____________________��
(3)CΪAl2(SO4)3��Һ����C���ɣ����գ����õ��Ĺ�������� ������B��C��ϣ���������ɫ��������ɫ���壬�÷�Ӧ�����ӷ���ʽΪ__________________��
(4)DΪCH3COONa��Һ�������£�pH��9��D�У�ˮ���������c(OH��)��________��
(5)EΪijŨ�ȵ�NH4Cl��Һ�������£� ��ø���Һ��pH=5��д������Һ��������ʽ�ľ�ȷ���(��ʽ)��c(Cl-)��c(NH4+)��_____________ mol/L��
(6)FΪMg(OH)2��Һ����������F������Һ��Mg2+�����ʵ���Ũ�ȣ�____________ mol/L(��֪����ʱ��Mg(OH)2���ܶȻ�Ksp��3.2��10-11)��
(7)GΪ������Һ��������Gʱ��Ϊ�˷�ֹ����ˮ�⣬���Լ��������� ��
���𰸡�(1) NH4+��H2O ![]() NH3��H2O��H����c(NH
NH3��H2O��H����c(NH![]() )>c(SO
)>c(SO![]() )>c(H��)>c(OH��)
)>c(H��)>c(OH��)
(2)HCO![]() �ĵ���С��ˮ����ʹ��Һ��c(OH��)>c(H��)
�ĵ���С��ˮ����ʹ��Һ��c(OH��)>c(H��)
(3) Al2(SO4)3 Al3����3HCO![]() ===Al(OH)3����3CO2��
===Al(OH)3����3CO2��
(4) 10-5 (5)10-5-10-9 (6)c(Mg2+)��2��10-4 mol/L (7)NaOH
��������
���������(1)0.1 mol��L��1��(NH4)2SO4��Һ����NH4+��ˮ����Һ��pH<7��ˮ�ⷴӦ�����ӷ���ʽΪNH4+��H2O ![]() NH3��H2O��H����笠�����ˮ���������Եõ���Һ�е�����Ũ�ȴ�СΪ��c(NH4+)��c(SO42-)��c(H+)��c(OH-)��
NH3��H2O��H����笠�����ˮ���������Եõ���Һ�е�����Ũ�ȴ�СΪ��c(NH4+)��c(SO42-)��c(H+)��c(OH-)��
(2)��NaHCO3��Һ�д���̼��������ӵ�ˮ��ƽ��Ϊ��HCO3+H2OH2CO3+OH-������ƽ��Ϊ��HCO3-H++CO32-������ˮ��Ϊ������̼��������ӵ�ˮ��̶ȴ��ڵ���̶���Һ�����Լ�����
(3)��Al2(SO4)3��ˮ��Һ��ˮ�����ɵ���Ϊ�ѻӷ��������ʰ�Al2(SO4)3��Һ���������������õ��Ĺ��������Al2(SO4)3 ������Al2(SO4)3 ��NaHCO3��Һ��ϣ���˫ˮ�ⷴӦ��������ɫ��������ɫ���壬�÷�Ӧ�����ӷ���ʽΪAl3++3HCO3-=Al(OH)3��+3CO2����
(4)��CH3COONa��Һ�У�OH-ȫ��������ˮ�ĵ��룬������Һ��pH=9������Һ�е�������Ũ��Ϊ10-9mol/L����ˮ���������c(OH-)=10-14��10-9=1.0��10-5molL-1��
(5)��NH4Cl��Һ�д��ڵ���غ�ʽc(NH4+)+c(H+)=c(Cl-)+c(OH-)����c(Cl-)��c(NH4+)��c(H+)-c(OH-)=(10-5-10-9)mol/L��
(6)��֪Ksp=c(M2+)��c2(OH-)����ֻ��M(OH)2�ı�����Һ�У�2c(Mg2+)=c(OH-)����c(M2+)=x����c(OH-)=2x����x��(2x)2=3.2��10-11����x=![]() =2��10-4��c(OH-)=4��10-4mol/L��c(Mg2+)=2��10-4mol/L��
=2��10-4��c(OH-)=4��10-4mol/L��c(Mg2+)=2��10-4mol/L��
(7)������Һ�д���S2-��ˮ��������������ʱ��Ϊ�˷�ֹ����ˮ�⣬���Լ���������NaOH��Һ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȵĺ������������ ClO-�� ClO2- �� ClO3-�� ClO4- �ȣ��������ǵ�˵������ȷ���ǣ� ��
A. ClO4-�� sp3 �ӻ� B. ClO3- �Ŀռ乹��Ϊ������
C. ClO2-�Ŀռ乹��Ϊֱ���� D. ClO- �� Cl ��+1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A��1mol�κ����ʵ������Լ��22.4L
B��1molH2��ռ�����Լ��22.4L
C��1molH2��1mol H2O�����ķ�������ͬ
D��16gN2��16gO2�����ķ�������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ�ڹ�ҵ��ҽ�Ƶ����������Ҫ��;��ij��ѧС��������ɰ�����Ĺ���������Ҫ����MgCO3��MgSiO3��Al2O3��Fe2O3�ȣ�������˻�������þ�Ĺ������̣�

��1�����ǰ���������������ĥ��Ŀ����_______��Ϊ�ﵽ��Ŀ�ģ������Բ�ȡ�Ĵ�ʩ��_____����дһ������
��2�����ʱ����������I�����ӷ���ʽΪ_________��
��3����һ�ε���pH��Ŀ����_____�������백ˮʹAl3+��ʼ����ʱ����Һ��c��Fe3+��/c��Al3+��Ϊ _________ ����֪Ksp[Fe(OH)3 ]=4��10-38��Ksp[Al(OH)3 ]=1��10-33.
��4����Ƽ�����������2������ʵ����̣�______��
��5����Һ3�пɻ������õ�������Ҫ��_____���ѧʽ�����������ӵĵ���ʽΪ _______��
��6��д����ҵ�ϴ�����3�л��þ�������з�Ӧ�Ļ�ѧ����ʽ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������һ�����͵�أ�����ͨ���ܵ����ȣ��õ�س�ʱ�䱣���ȶ��ķŵ��ѹ��������ص��ܷ�ӦΪ3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH������������ȷ���ǣ�������
3Zn(OH)2+2Fe(OH)3+4KOH������������ȷ���ǣ�������
A. �ŵ�ʱ����������Һ�ļ�����ǿ
B. �ŵ�ʱÿת��3mol���ӣ�������1mol K2FeO4������
C. �ŵ�ʱ������ӦΪ��Zn��2e��+2OH���TZn��OH��2
D. ��ԭ��أ�Zn������������ʯī��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������;��˵����������
A. ������������ˮ��
B. ���������������ͻ�����
C. ̼�ᱵ������ҽ���ϼ�鳦θ����������
D. �����£�����������������Ũ���ᡢŨ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г���ԭ�ӻ�����У������ڹ����ŵ���( )
A. �ǻ� B. ±ԭ�� C. ���� D. ��ϩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��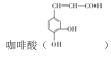 ���Ʊ�ij�ֿ�����ҩ�����Ҫԭ�ϡ��ɼױ��Ʊ�������ĺϳ�·�ߣ����ַ�Ӧ������ȥ����ͼ��ʾ��
���Ʊ�ij�ֿ�����ҩ�����Ҫԭ�ϡ��ɼױ��Ʊ�������ĺϳ�·�ߣ����ַ�Ӧ������ȥ����ͼ��ʾ��

��֪��
��1��������ķ���ʽΪ_____��������������______��
��2��A�Ľṹ��ʽΪ_____���÷��ӵĺ˴Ź����������֮��Ϊ______��
��3����Ӧ�ܵĻ�ѧ����ʽΪ________����Ӧ����Ϊ_______��
��4���������������Ŀ������ͬ���칹����_____�֡�
�ٱ�����������ȡ������1mol����������2molNaHCO3��Ӧ��
��5������F��̼̼˫�������ŵķ�����_______��
��6������ϩ��Ľṹ��ʽΪ![]() �������ṩ��Ϣii������Լױ�����ȩΪԭ���Ʊ�����ϩ��ĺϳ�·�ߡ�_______
�������ṩ��Ϣii������Լױ�����ȩΪԭ���Ʊ�����ϩ��ĺϳ�·�ߡ�_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ɵ����ϳɰ����ķ��������1918��ŵ������ѧ��������һ��ѹ�ܱ������г���1 mol N2��3 mol H2����һ�������·�����ӦN2��3H2![]() 2NH3 �������й�˵����ȷ���ǣ�
2NH3 �������й�˵����ȷ���ǣ�
A. N2��ȫת��ΪNH3ʱ��������Ϊ�ﵽ��ѧƽ��״̬��
B. �ﵽ��ѧƽ��ʱ��������ѹǿ�������ܶȶ����ٱ仯��
C. �ﵽ��ѧƽ��ʱ����Ӧ��ֹͣ���С�
D. �ﵽ��ѧƽ��ʱ��3��(��NH3)��2��(��H2)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com