
| A. | 铜丝 | B. | 稀硫酸 | C. | NaCl | D. | CO2 |
分析 在水溶液里或融融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不能导电的化合物是非电解质,无论是电解质还是非电解质都必须是化合物,据此分析.
解答 解:A.铜丝为金属单质,既不是电解质也不是非电解质,故A错误;
B.稀硫酸是硫酸的水溶液,是混合物,不是化合物,所以不是电解质,故B错误;
C.氯化钠是化合物,氯化钠在熔融状态下或在水中自身电离出自由移动的氯离子和钠离子能导电,氯化钠是电解质,故C正确;
D.二氧化碳在水溶液里,生成碳酸,碳酸能电离出自由移动的氢离子和碳酸根离子导致导电,不是二氧化碳自身电离,所以二氧化碳是非电解质,故D错误;
故选C.
点评 本题考查了电解质和非电解质的概念,题目难度不大,注意电解质和非电解质的区别.


科目:高中化学 来源: 题型:解答题
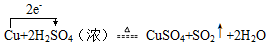 .实验测得,反应中生成了标准状况下的SO2气体44.8L,则耗氧化剂的物质的量为2mol.
.实验测得,反应中生成了标准状况下的SO2气体44.8L,则耗氧化剂的物质的量为2mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
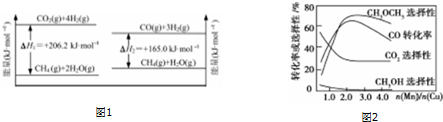
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
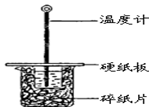 某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.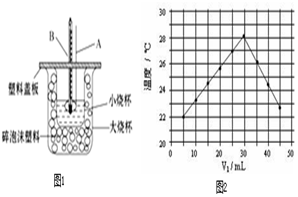
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Fe2+、Ba2+、NO3- | B. | Na+、K+、HCO3-、Cl- | ||
| C. | Ag+、Na+、NO3-、Cl- | D. | NH4+、Fe3+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
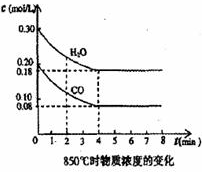 在一体积为 10L的密闭容器中,通入一定量的CO和H2O,在850℃发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图:
在一体积为 10L的密闭容器中,通入一定量的CO和H2O,在850℃发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com