
����Ŀ����ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ�ã���������ش��������⣺
I��ҵ���Ʊ�Na2S�ķ�Ӧԭ������
��Na2SO4(s)===Na2S(s)+2O2(g) ��H1=+1011.0kJ��mol��1
��C(s)+O2(g)===CO2(g) ��H2=��393.5kJ��mol��1
��2C(s)+O2(g)===2CO(g) ��H3=��221.0kJ��mol��1
��Na2SO4(s)+4C(s)===Na2S(s)+4CO(g) ��H4
��1����H4=___________ kJ��mol��1��
��2����Ӧ�����Է����е�������___________��
��3����ҵ���Ʊ�Na2S���÷�Ӧ�٣����÷�Ӧ�ܵ�������_____________________________��
��.��һ���¶��£���ij�����ܱ������г�������ʵ�����NO��CO������Ӧ��2NO(g)+2C0(g) ![]() 2CO2(g)+N2(B) ��H=��748kJ/mo1�������崫������ò�ͬʱ��NO��Ũ�����£�
2CO2(g)+N2(B) ��H=��748kJ/mo1�������崫������ò�ͬʱ��NO��Ũ�����£�
ʱ�䣨s�� | 0 | 10 | 20 | 30 | 40 | ���� |
C(NO)/mol/L | 0.100 | 0.050 | 0.025 | 0.010 | 0.010 | ���� |
��1��������¶��¸÷�Ӧ��K=______________________��
��2���ﵽƽ��ʱ�����д�ʩ�����NOת���ʵ���___________(�����)��
A.ѡ�ø���Ч�Ĵ���
B.���ͷ�Ӧ��ϵ���¶�
C.�������ʹ������ѹǿ����
D.����COʹ������ѹǿ����
��.��ҵ�ϳ��ó���������NO2���ķ�ˮ��
��1��O3����NO2���ɲ���NO3����O2����Ӧ��ÿ����1mol��O2ת��___________mol���ӡ�
��2��O3���ɵ��ϡ�����Ƶã�ԭ����ͼ��ͼ������Ϊ___________(����A������B��)������(���Ե缫)�ĵ缫��ӦʽΪ____________________________________________��

���𰸡�+569.0 �ϸ��¶��� һ����̼�ܱ������Ʋ������� 3.645x104 BD 2 B 3H2O-6e-==O3��+6H+
��������
I.��1�����ݸ�˹���ɼ��㣻
��2������H-T��S��0ʱ��Ӧ���Է����У�
��3�������ױ�����������
��.(1)����ƽ�ⳣ��K= c2(CO2)c(N2)/c2(NO)c2(CO)��������ݼ��㣻
��2�����ݻ�ѧƽ���ƶ�ԭ�����
��.��1����������Ϣ��д��ѧ����ʽ���ٸ��ݻ�ѧ����ʽ���㣻
��2�����ݷ�Ӧ�����ж�����������������Һ�������д�缫��Ӧʽ��
I.��1�����ݸ�˹���ɼ����+�ۡ�2�õ���Ӧ�ܵ��Ȼ�ѧ����ʽNa2SO4��s��+4C��s��=Na2S��s��+4CO��g�������H4=��+1011.0kJ��mol��1��+����221.0kJ��mol��1����2=+569.0kJ/mol���ʴ�Ϊ��+569.0��
��2����Ӧ�����ʱ��H��0����S��0�����������¡�H-T��S��0����Ӧ���Է����У��ʴ�Ϊ���ϸ��¶��£�
��3����ҵ���Ʊ�Na2S���÷�Ӧ������Ϊ�ֽ�����ɵ������ױ��������������÷�Ӧ�ܵ�ԭ������һ����̼���������ɱ��������Ʊ��������ʴ�Ϊ��һ����̼�ܱ������Ʋ���������
��.(1)�������֪��ʼʱc(NO)��c(CO)��Ϊ0.100mol/L��ƽ��ʱc(NO)Ϊ0.010mol/L����ƽ��ʱc(CO)��Ϊ0.010mol/L��c(CO2)��Ϊ0.090mol/L��c(N2)��Ϊ0.045mol/L��ƽ�ⳣ��K= c2(CO2)c(N2)/c2(NO)c2(CO)=(0.090mol/L)2��(0.045mol/L)/( 0.010mol/L)2��
(0.010mol/L)2=3.645x104���ʴ�Ϊ��3.645x104��
��2��A��ѡ�ø���Ч�Ĵ�����ֻ�ܸı䷴Ӧ���ʣ����ܸı�ƽ�⣬�ʴ���
B���÷�ӦΪ���ȷ�Ӧ�����ͷ�Ӧ�¶ȣ�ƽ��������У�һ������ת����������ȷ��
C���������ʹ������ѹǿ�����൱�ڼ�Сѹǿ����Сѹǿƽ����ѧ������������淴Ӧ�����ƶ���һ������ת���ʼ�С���ʴ���
D�����COʹ������ѹǿ����Ӧ��COŨ������ƽ��������У�һ������ת����������ȷ��
��ѡBD���ʴ�Ϊ��BD��
��.��1��O3����NO2���ɲ���NO3����O2����Ӧ�����ӷ���ʽΪO3+ NO2��= NO3��+O2���ɷ���ʽ��֪��Ӧ��ÿ����1mol��O2ת��2mol���ӣ��ʴ�Ϊ��2��
��2����ʾ��ͼ��֪����Ӧ��B��Ϊ���ص�������������ˮ������ԭ��Ӧ�ŵ�����������A��Ϊ���ص�������������ˮ����������Ӧ�ŵ����ɳ������缫��ӦʽΪ3H2O-6e-=O3��+6H+���ʴ�Ϊ��3H2O-6e-=O3��+6H+��


 ���ĺ����Ͼ�������ϵ�д�
���ĺ����Ͼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ�÷ֱ�������и������ʵĵ�����ʵ��,С���ݵ����ȱȷ�Ӧǰ���Լ�������

A. ������������Һ��ͨ������
B. ����������Һ��ͨ�������Ȼ���
C. ������ᱥ����Һ��ͨ����������
D. ������������Һ��ͨ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ơ��ȼ��仯�����������ת����ϵ��
�밴Ҫ����գ�
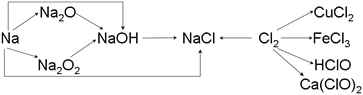
��1��ʵ�����н�����ͨ��������_______����һС�������Ͷ��ˮ�з�Ӧ�Ļ�ѧ����ʽ��________________��
��2��Na2O2�����ں�������У��йط�Ӧ�Ļ�ѧ����ʽΪ_____________________________��_________________________________��
��3�����Ƶ���ˮ������ɫʯ����Һ�У��۲쵽��������___________________________��
��д��������ˮ��Ӧ�Ļ�ѧ����ʽ_______________________________��
��4����ҵ����������ʯ���鷴Ӧ��Ư�ۣ��仯ѧ����ʽΪ_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����ɼ䱽���Ӻϳ�2-����-1��3-�����ӵ�ԭ�����£�

��֪��
���� | �䱽���� | 2-����-1��3-������ |
�۵� | 109��112�� | 84.85�� |
�е� | 276.5�� | 234�� |
�ܽ��� | ������ˮ | ����ˮ |
��Է������� | 110 | 155 |
ʵ��ҩƷ���䱽���ӡ�Ũ����(98%)�������(��Ũ�����Ũ���ᰴ2��3������Ȼ�϶���)�����صȡ�
ʵ�鲽�裺
��.��ȡ2.7g�䱽���ӷ�ĩ������100mL��ƿ�У��ټ���13mLŨ���ᣬͬʱ��ֽ��裬��Ӧ���ȣ��������ɰ�ɫ�ǻ��
��.����Ӧ����ȴ���õιܵμ�Ԥ���ñ�ˮԡ��ȴ�õĻ���ᣬͬʱ���н��裬��ʹ��Ӧ�¶�������30�森�����ɵĻ�ɫճ��״Һ���������·���15min������7.5mL�����������ˮϡ�ͣ������¶���50�����£��õ����ɫ�ij�״Һ�塣
��.����ӦҺת����250mL��ƿ��(������ͼ��ʾ���гֺͼ���װ�þ�����ȥ)���ټ���0.1g���أ�������������Һͨ�����ˣ�ϴ�Ӹ���ɵõ��ٺ�ɫƬ״�����Ʒ��

�Իش��������⣺
(1)���в�������ʱ����ȴˮӦ��______(����a������b��)�ڽ��롣
(2)ʵ������У��¶ȿ����ڽϵ��¶��½��е�ԭ������ǣ�______��
(3)ʵ����������ƻ������ȷ�����ǣ�______��
(4)�������أ���Ŀ����ʹ�������������ط�Ӧ������ȥ�����з�Ӧ֮һ�Ļ�ѧ����ʽΪ��2CO(NH2)2+6HNO3=NH4NO3+8NO��+2CO2��+5H2O��������1.12LCO2(��״����)ʱ����ת�Ƶĵ�����Ϊ______��
(5)�Դ�Ʒ����(����)����߲�Ʒ���ȡ��������������ò�Ʒ������Ϊ 2.1g���������Ϊ______(������λС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼����Ԫ�ؼ��仯�����������������������������Իش������й����⣺
��1��NH3��������ˮ����ˮ��Һ�׳ư�ˮ����ˮϡ��0.1molL-1�İ�ˮ����Һ������ˮ�������Ӷ���С����___________������ţ���
A��![]() B��
B��![]() C��c(H+)c(OH-) D��
C��c(H+)c(OH-) D��![]()
��2��NO2���ð�ˮ��������NH4NO3��25��ʱ����amolNH4NO3����ˮ����Һ�����ԣ�ԭ����______________�������ӷ���ʽ��ʾ���������Һ�еμ�bL��ˮ����Һ�����ԣ���μӰ�ˮ�Ĺ�����ˮ�ĵ���ƽ�⽫________�������������������������������ƶ������μӰ�ˮ��Ũ��Ϊ________mol/L-1����NH3��H2O�ĵ���ƽ�ⳣ��ΪKb=2��10-5��
��3���Լ���Ϊȼ�ϵ����͵�صijɱ�������������Ϊȼ�ϵĴ�ͳȼ�ϵ�أ���ͼ��Ŀǰ�о��϶��һ�����������ȼ�ϵ�صĹ���ԭ��ʾ��ͼ��

��B�缫�ķ�ӦʽΪ_______________________��
�����ø�ȼ�ϵ������Դ����ʯī���缫���100 mL 1 mol��L��1������ͭ��Һ���������ռ���������������ʱ�����������ļ�������Ϊ_________(��״��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£��ں����ܱ������У��ܱ�ʾ��ӦX(s)+2Y(g)![]() 2Z(g)һ���ﵽ��ѧƽ��״̬��
2Z(g)һ���ﵽ��ѧƽ��״̬��
��������������ܶȲ��ٷ����仯 ��Y��Ũ�Ȳ��ٷ����仯
�������е�ѹǿ���ٷ����仯 �ܵ�λʱ��������2mol Z��ͬʱ����2mol Y
A. �٢� B. �ڢ� C. �ۢ� D. �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������������������ȷ���ǣ� ��
A. ��״���£�3.36LCCl4�к��У�7.5NA��ԭ��
B. ���³�ѹ�£�32gO2��O3�Ļ�����к��е���ԭ����ԼΪ1.204��1024
C. CO2�ͱ�״����11.2LHCl������ͬ��ԭ����
D. 1L0.1mol/L��CH3COOH��Һ�У�H+����ĿΪ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�Ȼ�ѧ����ʽ��2H2(g)+O2(g) ![]() 2H2O(l) H= -571.6 kJ��mol-1��2CH3OH(l)+3O2(g)
2H2O(l) H= -571.6 kJ��mol-1��2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) H= -1452 kJ��mol-1��H+(aq)+OH��(aq)
2CO2(g)+4H2O(l) H= -1452 kJ��mol-1��H+(aq)+OH��(aq) ![]() H2O(l) H= -57.3 kJ��mol-1���ݴ��ж�����˵����ȷ����
H2O(l) H= -57.3 kJ��mol-1���ݴ��ж�����˵����ȷ����
A. CH3OH��ȼ����Ϊ1452 kJ��mol-1
B. 2H2(g)+O2(g) ![]() 2H2O(g) H > -571.6 kJ��mol-1
2H2O(g) H > -571.6 kJ��mol-1
C. CH3COOH(aq)+NaOH(aq) ![]() H2O(l)+CH3COONa(aq) H= -57.3 kJ��mol-1
H2O(l)+CH3COONa(aq) H= -57.3 kJ��mol-1
D. 2CH3OH(l)+O2(g) ![]() 2CO2(g)+4H2(g) H= -880.4 kJ��mol-1
2CO2(g)+4H2(g) H= -880.4 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����NOx��SO2�ȴ�����Ⱦ��Ը������ǵ����滷��������Ҫ����ʵ���塣
��1�����ü������ԭ���������֪��
CH4(g) +4NO2(g) =4NO(g)+CO2(g) +2H2O(g)����H=-574kJmol-1
CH4(g)+2NO2(g)=N2(g) +CO2(g)+2H2O(g)����H=-867kJmol-1
��CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)����H=____________________
��2��������������������������£�
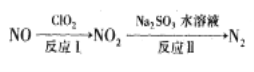
��֪��ӦI�Ļ�ѧ����ʽΪ2NO+ClO2+H2O=NO2+HNO3+HCl������ӦI��ת��3mol���ӣ���Ӧ���п�����N2�����Ϊ_____L����״���£���
��3�������£���NaOH��Һ����SO2�õ�pH=9��Na2SO3��Һ�����չ�����ˮ�ĵ���̶�_____������������������С������������������д��Na2SO3��Һ�У�c(Na+)��c(H2SO3)��c(SO32-)��c(HSO3-)�Ĵ�С��ϵ��_____��
��4������Fe2��SO4��3��ҺҲ�ɴ���SO2����������Fe2+��Һ�кܶ���Ҫ��;������1.8molL��1��FeSO4��Һʱ��Ϊ��ֹ��Һ��Fe2+��������������_____��Ϊȷ����Һ�в����ֻ��ǣ�Ӧ������Һ��pH������_____���������£�Ksp[Fe(OH) 2]=1.8��10��16��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com