
| A. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| B. | Y的氢化物比R的氢化物稳定,熔沸点高 | |
| C. | Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z | |
| D. | RY2、WY2通入Ba(NO3)2溶液中均无白色沉淀生成 |
分析 X、Y、Z、W、R属于短周期主族元素,X的原子半径是短周期主族元素中最大的,则X为Na元素;
Z元素的原子L层电子数为m+n,M层电子数为m-n,则m+n=8且m>n,Y元素的原子最外层电子数为m,次外层电子数为n,次外层为K层,则n=2,所以m=6,则Y是O元素、Z为Si元素;
W元素与Z元素同主族,则W为C元素;
R元素原子与Y元素原子的核外电子数之比为2:1,则R原子核外有16个电子,为S元素,
所以X、Y、Z、W、R分别是Na、O、Si、C、S元素;
A.X和Y可以形成两种离子化合物,分别为Na2O、Na2O2;
B.元素的非金属性越强,其氢化物越稳定,氢化物的熔沸点与分子间作用力成正比,含有氢键的氢化物熔沸点较高;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.SO2和Ba(NO3)2溶液发生氧化还原反应,CO2和Ba(NO3)2溶液不反应.
解答 解:X、Y、Z、W、R属于短周期主族元素,X的原子半径是短周期主族元素中最大的,则X为Na元素;
Z元素的原子L层电子数为m+n,M层电子数为m-n,则m+n=8且m>n,Y元素的原子最外层电子数为m,次外层电子数为n,次外层为K层,则n=2,所以m=6,则Y是O元素、Z为Si元素;
W元素与Z元素同主族,则W为C元素;
R元素原子与Y元素原子的核外电子数之比为2:1,则R原子核外有16个电子,为S元素,
所以X、Y、Z、W、R分别是Na、O、Si、C、S元素;
A.X和Y可以形成两种离子化合物,分别为Na2O、Na2O2,其阴阳离子个数之比都是1:2,故A正确;
B.元素的非金属性越强,其氢化物越稳定,氢化物的熔沸点与分子间作用力成正比,含有氢键的氢化物熔沸点较高,非金属性Y>R,所以氢化物的稳定性Y>R,Y的氢化物中含有氢键、R的氢化物中不含氢键,所以氢化物的熔沸点:Y>R,故B正确;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性R>W>Z,所以Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z,故C正确;
D.SO2和Ba(NO3)2溶液发生氧化还原反应生成硫酸钡白色沉淀,碳酸酸性小于硝酸,所以CO2和Ba(NO3)2溶液不反应,没有明显现象,故D错误;
故选D.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生判断及知识综合运用能力,明确原子结构、元素周期表结构、元素周期律及元素化合物性质是解本题关键,注意:氢化物的稳定性与化学键有关,氢化物的熔沸点与分子间作用力有关,易错选项是D.


科目:高中化学 来源: 题型:解答题
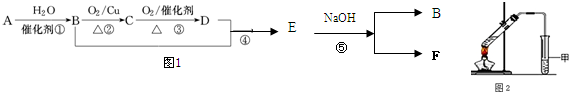
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3-、CO32-、SiO32-、SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 想该溶液中加入足量稀盐酸 | 生成白色沉淀并在标准状况下放出0.56L气体 |
| Ⅱ | 将Ⅰ中产生的混合液过滤,将沉淀洗涤、灼烧至恒重,称量所得固体的质量 | 固体质量为2.4g |
| Ⅲ | 向Ⅱ中所得的滤液中滴加BaCl2溶液 | 无明显现象 |
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c/mol•L-1 | ? | 0.25mol/L | 0.4mol/L | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
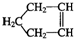 可简写为
可简写为 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为:
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH-CH═CH2 | B. | 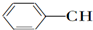 ═CH2 ═CH2 | C. | 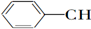 ═CH-CH2 ═CH-CH2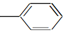 | D. | 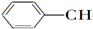 ═CH-CH═ ═CH-CH═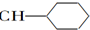 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当正反应与逆反应速率相等时,平衡不移动 | |
| B. | 当正反应大于逆反应速率时,平衡向正反应方向移动 | |
| C. | 当正反应小于逆反应速率时,平衡向正反应方向移动 | |
| D. | 反应速率发生改变,平衡不一定发生移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com