
| A. | 海水提镁的过程为:MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO$\stackrel{电解}{→}$Mg | |
| B. | 石油裂化的主要目的是提高汽油等轻质燃油的产量 | |
| C. | 煤干馏的产品很多,属于化学变化 | |
| D. | 海水提溴是将海水中的化合态的溴富集再转化为游离态的溴 |
分析 A、海水提镁的过程中从海水中沉淀镁离子,加入盐酸溶解得到氯化镁,再电解熔融氯化镁得镁;
B、石油裂化的主要目的是将长的碳链断裂成短的碳链,得到汽油;
C、煤干馏是将煤隔绝空气加强热,产生很多新物质;
D、工业上海水中提取溴是利用氧化剂氧化溴离子为溴单质,通过碳酸钠吸收溴单质后,得到溴离子和溴酸根离子,再加入酸反应生成溴单质,将海水中的化合态的溴富集再转化为游离态的溴;
解答 解:A、海水提镁的过程中从海水中得到氯化镁,得到氯化镁固体再电解熔融氯化镁得镁,氧化镁熔点高不能电解制备金属镁,故A错误,
B、石油裂化的主要目的是将长的碳链断裂成短的碳链,得到汽油,以提高汽油的产量,故B正确;
C、煤干馏是将煤隔绝空气加强热,产生很多新物质,所以是化学变化,故C正确;
D、根据工业上海水中提取溴的方法可知,是先将海水中的化合态的溴富集再转化为游离态的溴,故D正确;
故选A.
点评 本题考查海水资源及其综合利用、煤和石油的加工等,题目难度中等,注意工业上用电解法制镁的方法、海水提溴、海水提镁的工业生产流程的理解应用.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:填空题
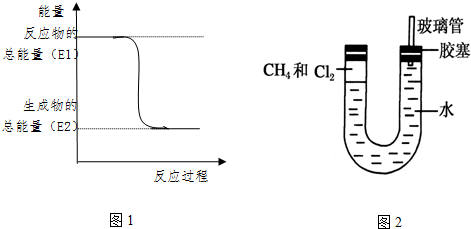
 .一定量的该气体燃烧过程的能量变化如图1所示,从图中可以读出E1>E2(填“>”或“<”),该反应放出 (填“放出”或“吸收”)能量.
.一定量的该气体燃烧过程的能量变化如图1所示,从图中可以读出E1>E2(填“>”或“<”),该反应放出 (填“放出”或“吸收”)能量.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
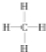
 某兴趣小组设计出如图所示装置来进行“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来进行“铜与硝酸反应”实验,以探究化学实验的绿色化.| 方 案 | 反 应 物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
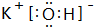 ②HClO的结构式H-O-Cl
②HClO的结构式H-O-Cl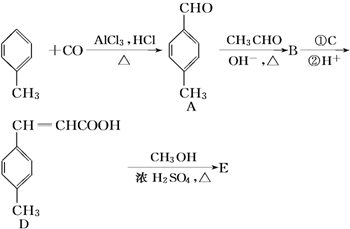
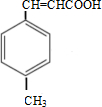 +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$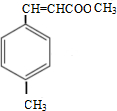 +H2O
+H2O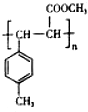 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电子式: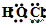 | |
| B. | 质子数为6、质量数为14的原子:${\;}_6^{14}N$ | |
| C. | CS2的结构式:S=C=S | |
| D. | 氯的原子结构示意图: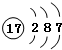 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.5 pmol | B. | (3m+$\frac{n}{2}$-3p)mol | C. | (3m+$\frac{n}{2}$)mol | D. | (3m+n)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L氟化氢中含有分子的数目为0.5NA | |
| B. | 常温下a克某烷烃(CnH2n+2)中含有共用电子对数目为$\frac{a}{14n+2}$(3n+1)NA | |
| C. | 56g 聚乙烯中含有碳碳双键的数目为2NA | |
| D. | 常温下,0.2mol/L的FeCl3溶液中含Cl-数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16.9 克过氧化钡(BaO2)固体中阴阳离子总数为0.3NA | |
| B. | 标准状况下,11.2L CHCl3中所含有的原子总数为2.5NA | |
| C. | 一定条件下,2.6 g 乙炔、苯的气态混合物中所含碳原子数为0.2NA | |
| D. | 1 mol 甲基与1mol 羟基所含电子数均为10 NA 个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| L | M | Q | R | T | |
| 原子半径 | 0.160 | 0.143 | 0.104 | 0.111 | 0.066 |
| 王要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L 和 Q 形成的化合物含极性共价键 | |
| B. | L、R 的单质与盐酸反应速率:R>L | |
| C. | T、Q 的氢化物常温常压下均为无色气体 | |
| D. | M 极易与 T 反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com