
| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
分析 C4H8ClBr可以可知丁烷中的2个H原子分别为1个Cl、1个Br原子取代,丁烷只有2种结构,氯原子与溴原子可以取代同一碳原子上的H原子,可以取代不同碳原子上的H原子,据此书写判断.
解答 解:先分析碳骨架异构,分别为 C-C-C-C 与 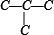 2种情况,然后分别对2种碳骨架采用“定一移一”的方法分析:
2种情况,然后分别对2种碳骨架采用“定一移一”的方法分析:
①骨架C-C-C-C上分别添加Cl、Br原子的种类有: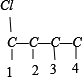 、
、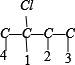 共8种,
共8种,
②骨架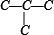 上分别添加Cl、Br原子的种类有有:
上分别添加Cl、Br原子的种类有有: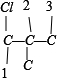 、
、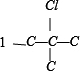 ,共 4 种,
,共 4 种,
所以满足分子式为C4H8ClBr的有机物共有12种,
故选D.
点评 本题考查同分异构体的书写,题目难度中等,明确同分异构体的书写原则为解答关键,注意掌握“定一移一”法在确定有机物同分异构体中的应用方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | A>B>C | B. | A>C>B | C. | C>B>A | D. | B>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度可使该反应的逆反应速率降低 | |
| B. | 使用高效催化剂只能提高正反应速率 | |
| C. | 反应达到平衡后,NO的反应速率为零 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③①② | B. | ②①③ | C. | ③②① | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量铁粉溶于稀HNO3中:Fe+NO3-+4H+═Fe3++NO↑+2H2O | |
| B. | 过量NaHSO4溶液加入到Ba(OH)2溶液中:2H++SO42-+Ba2++2 OH-═2H2O+BaSO4↓ | |
| C. | 少量Cl2通人FeBr2溶液中:2 Br-+Cl2═2 Cl-+Br2 | |
| D. | 少量 AlCl3溶液滴入到氨水中:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示:
将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com