
下列化学用语使用正确是
A.氧原子能量最高的电子的电子云图:
B.35Cl与 37Cl互为同素异形体
C.CH4分子的比例模型:
D.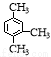 的命名:1,3,4-三甲苯
的命名:1,3,4-三甲苯
科目:高中化学 来源:2014-2015学年天津市和平区高三第二次模拟考试理综化学试卷(解析版) 题型:简答题
(14分)钠及其化合物具有广泛的用途。
(1)工业上制备金属钠的常用方法是____________。试写出制备金属钠的化学方程式 。金属钠可用于 (写出Na在熔点低方面的一种用途)。
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示:

①正极的电极反应式为___________,电池工作时物质A可循环使用,A物质的化学式为_____________。
②请写出检验Na2CO3中钠元素的方法 。
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 11.6 | 10.3 | 11.1 |
上述盐溶液的阴离子中,结合H+能力最强的是 ,根据表中数据,浓度均为0.01 mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是_______(填序号)。
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯。
①常温下,当300 mL 1 mol·L-1的NaOH溶液吸收4.48 L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为________________________。
②已知几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]______Ksp[Mg(OH)2](填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市第二次诊断性测试化学试卷(解析版) 题型:选择题
已知X和Y能发生如下反应:X+Y===H2O+盐,下列有关物质X和Y所属类别的判断中一定不正确的是
A | B | C | D | |
X | 碱 | 酸 | 酸式盐 | 羧酸 |
Y | 两性氧化物 | 碱性氧化物 | 碱 | 醇 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:选择题
某未知溶液可能含Na+、NH4+、Fe2+、I-、Cl-、CO32-、SO32-。将该溶液加少量新制氯水,溶液变黄色。再向上述反应后溶液中加入BaCl2溶液或淀粉溶液,均无明显现象。下列推断合理的是
A.一定存在Fe2+、Na+、Cl- B.一定不存在I-、SO32-
C.一定呈碱性 D.一定存在NH4+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:选择题
下图可设计成多种用途的电化学装置。下列分析正确的是

A.当a和b用导线连接时,溶液中的SO42-向铜片附近移动
B.将a与电源正极相连可以保护锌片,这叫牺牲阳极的阴极保护法
C.当a和b用导线连接时,铜片上发生的反应为:2H++2e →H2↑
D.a和b用导线连接后,电路中通过0.02mol电子时,产生0.02mol气体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省鹰潭市高三第二次模拟考试理综化学试卷(解析版) 题型:简答题
(14分)研究氮及其化合物的性质在人类进步过程中具有极为重要的意义。
(1)已知反应:
①2H2(g)+O2(g) 2H2O(g) △H=-483.6 kJ/mol
2H2O(g) △H=-483.6 kJ/mol
②N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
③4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ/mol
4NO(g)+6H2O(g) △H=-905kJ/mol
则反应④4NH3(g)+3O2(g) 2N2(g)+6H2O(g)的△H=___________。
2N2(g)+6H2O(g)的△H=___________。
(2)在恒温恒容的甲容器,恒温恒压的乙容器中分别进行合成氨反应(图中所示数据均为初始物理量)。t分钟后反应均达到平衡,生成NH3均为0.4mol(忽略水对压强的影响及氨气的溶解)。
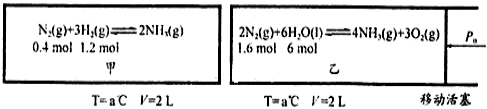
①该条件下甲容器中反应的平衡常数K= ;平衡时,甲容器的压强P = (初始压强用P0表示)。
②该条件下,若向乙中继续加入0.2 mol N2,达到平衡时N2转化率= 。
(3)在实验室中,某同学利用下列试剂及器材完成的实验能够证明NH3·H2O是弱电解质的是_________(选填字母代号)。
A.用氨水做导电性实验,灯泡昏暗
B.将氨水滴入AlCl3溶液中,产生白色沉淀
C.常温下,用pH试纸测得0.1mol/L氨水的pH<13
D.用湿润的蓝色石蕊试纸测得NH4Cl溶液为紫色
(4)常温下,向1molL-1NH4Cl溶液中通入少量的NH3此时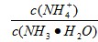 的值 (填“增大”、“减小”或“不变”);若将1molL-1NH4Cl溶液和1molL-1NaOH溶液混合后溶液恰好呈中性,则混合前NH4Cl溶液的体积 NaOH溶液的体积(填“大于”、“小于”或“等于”).
的值 (填“增大”、“减小”或“不变”);若将1molL-1NH4Cl溶液和1molL-1NaOH溶液混合后溶液恰好呈中性,则混合前NH4Cl溶液的体积 NaOH溶液的体积(填“大于”、“小于”或“等于”).
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省鹰潭市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.H2O在高温下难分解,而H2S在300℃时就分解,说明O非金属性比S强。
B.H2CO3的酸性比HClO的酸性强,所以C的非金属性比Cl强。
C.NaOH的碱性比Mg(OH)2的碱性强, 所以Na的金属性比Mg强。
D.Fe3+的氧化性比Cu2+的氧化性强,但Fe的金属性比Cu强。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省岳阳市高三质量检测(二)理综化学试卷(解析版) 题型:填空题
【化学—选修3:物质结构与性质】(15分)已知位于元素周期表前四周期的六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大。B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同。请回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序是____________(填元素符号)
(2)化合物BD3的分子空间构型可描述为_________,B的原子轨道杂化类型为_______。
(3)已知F元素在人体内含量偏低时,会影响O2在体内的正常运输。已知F2+与KCN溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物。则F的基态原子价电子排布式为________________。CN-与___________(一种分子)互为等电子体,则1个CN-中π键数目为___________。
(4)EO2与碳酸钡在熔融状态下反应,所得晶体的晶胞结构如图所示,则该反应的化学方程式为__________
在该晶体中,E4+的氧配为数为___________。若该晶胞边长为a nm可计算该晶体的密度为__________g/cm3(阿伏加德罗常数为NA)
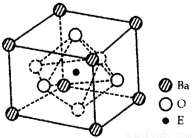
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省湛江市高三普通高考测试(二)理综化学试卷(解析版) 题型:实验题
(16分)某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:
(1)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:
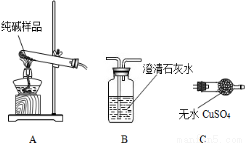
选择的装置 (填编号) | 实验现象 | 实验结论 |
样品含 NaHCO3 |
(2)测定该纯碱样品的纯度:称取m1g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应 混和物过滤、 (填操作)、干燥、称量为m2g。该纯碱样品的纯度为 。
(3)该小组同学在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,溶液没有什么变化,但加热后显淡红色,加热较长时间后冷却,红色不褪去。为探究原因,进行了下列实验:
实验1:加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
温度(℃) | 10 | 20 | 30 | 50 | 70 | 80 | 100 |
pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 | 9.6 | 10.1 |
但当温度恢复到10℃,测得溶液pH=9.8。
实验2:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,澄清石灰水变浑浊。
①用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外) 、_________。这两个平衡以__________为主。
②结合实验1、2分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是________________(答一条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com