
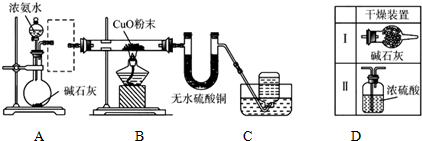
分析 (1)熟悉仪器的形状,说出其名称;浓氨水滴到生石灰上,生石灰与水反应生成氢氧化钙,放出热量,且氢氧化钙电离产生氢氧根离子,抑制一水合氨的电离,促进氨气的逸出;
(2)制备的氨气中含有水蒸气,进入B容易炸裂试管,应进行干燥;氨气为碱性气体,应选择碱性干燥剂;
(3)氨气还原氧化铜生成铜和氮气和水;
(4)使用”固-固加热型”装置制取氨气,可以选择氯化铵与氢氧化钙为原料,二者在加热条件下生成氨气.
解答 解:(1)图中A中盛放浓氨水的仪器为分液漏斗;浓氨水滴到生石灰上,生石灰与水反应生成氢氧化钙,方程式:CaO+H2O=Ca(OH)2,放出热量,促进氨气的逸出:方程式:NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
故答案为:分液漏斗;CaO+H2O=Ca(OH)2,NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(2)制备的氨气中含有水蒸气,进入B容易炸裂试管,应进行干燥;氨气为碱性气体,应选择碱性干燥剂,碱石灰为碱性干燥剂,可以干燥氨气,浓硫酸与氨气反应,不能用来干燥氨气;
故答案为:是;Ⅰ;
(3)氨气还原氧化铜生成铜和氮气和水,方程式:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
故答案为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
(4)氯化铵与氢氧化钙都是固体,二者在加热条件下反应生成氯化钙、氨气和水,方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
点评 本题考查了氨气的制备和性质的检验,明确实验原理及氨气的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Si和Na | B. | B和H | C. | Cl和C | D. | C和Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 甲 | 乙 | 丙 | |
| 所含元素 | C、H | C、H、F | C、H、F |
| 所含电子数 | 26 | ||
| 结构特点 | 饱和有机物 | ||
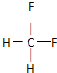 .下列关于乙的叙述正确的是D.
.下列关于乙的叙述正确的是D.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
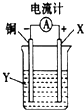
| A. | X可以是银或石墨 | B. | Y是硫酸铜溶液 | ||
| C. | 电子从铜电极经外电路流向X电极 | D. | X极发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com