
【题目】根据题意填空
(1)常温下某溶液中由水电离出的离子浓度符合c(H+)c(OH﹣)=1×10﹣20的溶液,其pH为 , 此时水的电离受到
(2)在某温度下,H2O的离子积常数为1×10﹣13 mol2L﹣2 , 则该温度下:100mL 0.1molL﹣1H2SO4溶液与100mL 0.4molL﹣1的KOH溶液混合后,pH= .
(3)已知一溶液有4种离子:X+、Y﹣、H+、OH﹣ , 下列分析结果肯定错误的是
A.c(Y﹣)>c(X+)>c(H+)>c(OH﹣)
B.c(X+)>c(Y﹣)>c(OH﹣)>c(H+)
C.c(H+)>c(Y﹣)>c(X+)>c(OH﹣)
D.c(OH﹣)>c(X+)>c(H+)>c(Y﹣)
(4)在25℃下,将a molL﹣1的氨水与0.01molL﹣1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl﹣).则溶液显(填“酸”“碱”或“中”)性;用含a的代数式表示NH3H2O的电离常数Kb= .
(5)水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值:
HClO:Ka=3×10﹣8 H2CO3:Ka1=4.3×10﹣7 Ka2=5.6×10﹣11;84消毒液中通入少量的CO2 , 该反应的化学方程式为
【答案】
(1)4或10;抑制
(2)12
(3)C
(4)中;![]()
(5)NaClO+CO2+H2O═HClO+NaHCO3
【解析】解:(1)常温下某溶液中由水电离出的离子浓度符合c(H+)c(OH﹣)=1×10﹣20的溶液中满足:c(H+)=c(OH﹣)=1×10﹣10mol/L,则该溶液抑制了水的电离,为酸性或碱性溶液,溶液的pH可能为4或10,
所以答案是:4或10;抑制;(2)在某温度下,H2O的离子积常数为1×10﹣13 mol2L﹣2 , 则该温度下:100mL 0.1molL﹣1H2SO4溶液和100mL 0.4molL﹣1的KOH溶液混合,n(H2SO4)=0.1mol/L×0.1L=0.01mol,n(KOH)=0.4mol/L×0.1L=0.04mol,KOH有剩余,混合溶液中c(OH﹣)= ![]() mol/L=0.1mol/L,c(H+)=
mol/L=0.1mol/L,c(H+)= ![]() mol/L=10﹣12mol/L,pH=12,所以答案是:12;(3)A.当溶液为酸性时,可以满足关系:c(Y﹣)>c(X+)>c(H+)>c(OH﹣),故A正确;
mol/L=10﹣12mol/L,pH=12,所以答案是:12;(3)A.当溶液为酸性时,可以满足关系:c(Y﹣)>c(X+)>c(H+)>c(OH﹣),故A正确;
B.当溶液呈碱性时可以满足c(X+)>c(Y﹣)>c(OH﹣)>c(H+),故B正确;
C.该关系c(H+)>c(Y﹣)>c(X+)>c(OH﹣)无法了电荷守恒,故C错误;
D.当溶液呈碱性,且YOH远远过量时可以满足c(OH﹣)>c(X+)>c(H+)>c(Y﹣),故D正确;
所以答案是:C;(4)在25℃下,平衡时溶液中c(NH4+)=c(Cl﹣)=0.005mol/L,根据物料守恒得c(NH3H2O)=(0.5a﹣0.005)mol/L,根据电荷守恒得c(H+)=c(OH﹣)=10﹣7mol/L,溶液呈中性,NH3H2O的电离常数Kb= ![]() =
= ![]() =
= ![]() ,
,
所以答案是:中; ![]() ; (5)酸的电离平衡常数越大,酸的酸性越强,强酸能和弱酸盐反应生成弱酸,根据电离平衡常数知,酸性H2CO3>HClO>HCO3﹣ , 则次氯酸钠和二氧化碳水反应生成碳酸氢钠和次氯酸,反应方程式为NaClO+CO2+H2O═HClO+NaHCO3 ,
; (5)酸的电离平衡常数越大,酸的酸性越强,强酸能和弱酸盐反应生成弱酸,根据电离平衡常数知,酸性H2CO3>HClO>HCO3﹣ , 则次氯酸钠和二氧化碳水反应生成碳酸氢钠和次氯酸,反应方程式为NaClO+CO2+H2O═HClO+NaHCO3 ,
所以答案是:NaClO+CO2+H2O═HClO+NaHCO3 .


科目:高中化学 来源: 题型:
【题目】意大利科学家最近合成了一种新型的氧分子,其化学式为O4,对其说法正确的是( )
A. O4是一种化合物 B. O4是由O2组成的混合物
C. O4是一种单质 D. 一个O4分子由2个O2分子构成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NH4NO3溶于水得无色溶液,为使该溶液中的c(NH ![]() ):c(NO
):c(NO ![]() )=1:1,可以采取的下列措施是( )
)=1:1,可以采取的下列措施是( )
A.加入适量的HNO3 , 抑制NH ![]() 水解
水解
B.加入适量的氨水,使溶液的pH等于7
C.再加入适量的NH4NO3(s)
D.加入适量的NaOH,使溶液的pH等于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备氮化镁的装置示意图如下: 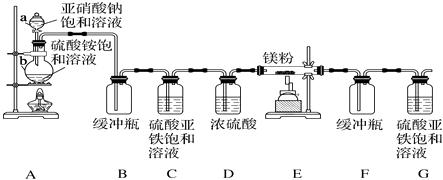
回答下列问题:
(1)仪器a的名称是 , b的名称是 .
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式: .
(3)C的作用是 .
(4)写出E中发生反应的化学方程式: .
(5)请用化学方法确定氮化镁是否含有未反应的镁,写出实验操作及现象 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示. 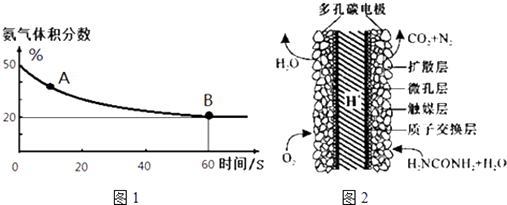
A点的正反应速率v正(CO2)B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);氨气的平衡转化率为 .
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)将实验测得的不同温度下的平衡数据列于表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度 (10﹣3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①关于上述反应的焓变、熵变说法正确的是 .
A.△H<0,△S<0B.△H>0,△S<0 C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.
此时溶液中c(NH4+)=;(填具体数值)NH4+水解平衡常数值为 .
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g铜镁合金完全溶解于足量的浓硝酸中,得到NO2气体1344mL (标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,发现金属离子全部沉淀,下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B.可得到2.54 g沉淀
C.如果是铜铝合金,则产生的NO2 的体积不会是1344mL
D.恰好全部沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,下列各组热化学方程式中△H2>△H1的是( )
A.2H2(g)+O2(g)═2H2O(g),△H1;? 2H2(g)+O2(g)═2H2O(l),△H2
B.S(s)+O2(g)═SO2(g),△H1; ?S(g)+O2(g)═SO2(g),△H2
C.C(s)+ ![]() ?O2(g)═CO(g),△H1;? C(s)+O2(g)═CO2(g),△H2
?O2(g)═CO(g),△H1;? C(s)+O2(g)═CO2(g),△H2
D.H2(g)+Cl2(g)═2HCl(g),△H1;? ![]() H2(g)+
H2(g)+ ![]() ?Cl2(g)═HCl(g),△H2
?Cl2(g)═HCl(g),△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请填写以下空白:
(1)有以下物质: ①NaHSO4晶体 ②SO3 ③液态硫酸 ④铁 ⑤BaSO4固体 ⑥饱和 FeCl3溶液 ⑦
酒精(C2H5OH) ⑧熔融的 K2SO4,其中能导电的是__________,属于电解质的是_________,属于非电解质的是______________
(2) 化学反应 FeS+ H2SO4(浓)![]() Fe2(SO4)3+ SO2↑+ S↓+ H2O(未配平)中:
Fe2(SO4)3+ SO2↑+ S↓+ H2O(未配平)中:
氧化产物是:_______, 还原产物是:_______。
(3) 请写出醋酸与氢氧化钠溶液反应的离子方程式_______。
(4) 盐酸可以除铁锈, 请写出发生反应的离子方程式_______。
(5) 工业上常用 H2O2在酸性条件下氧化污水中的 Fe2+,请写出离子方程式:_______。
(6)某液态化合物 X2Y4常用作火箭燃料。 32 g X2Y4在一定量的 O2中恰好完全燃烧,反应方程式为: X2Y4(l)+O2(g) ![]() X2(g)+2Y2O(l)。冷却后在标准状况下测得生成物的体积为 22.4 L,其密度为 1.25 g·L-1。 X2的摩尔质量为_____________, X2Y4化学式为________________。(注: l—液态, g—气态)
X2(g)+2Y2O(l)。冷却后在标准状况下测得生成物的体积为 22.4 L,其密度为 1.25 g·L-1。 X2的摩尔质量为_____________, X2Y4化学式为________________。(注: l—液态, g—气态)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所涉及的物质均为中学化学中的常见物质,其中D为黄绿色气体,E为Fe,除D、E、C外余化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。
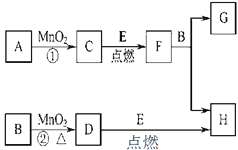
(1)指出MnO2在相关反应中的作用:反应①中是________剂,反应②中是_______剂。
(2)若反应①是在加热条件下进行,则A的化学式是__________;若反应①是在常温条件下进行,则A的化学式是__________。
(3)写出B与MnO2共热获得D的化学方程式_________________________________,该反应中B体现了___________性。
(4)写出F与B反应的离子方程式 ________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com