
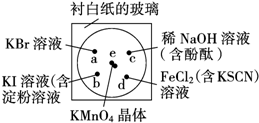
 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求,某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L 的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求,某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L 的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)分析 (1)高锰酸钾具有强氧化性,能把盐酸氧化生成氯气,自身被还原生成氯化锰,据此写出反应方程式;
(2)b处氯气能置换出碘,碘遇淀粉变蓝色;
(3)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;标准状况下,当有0.224L Cl2被NaOH溶液吸收后,氯气物质的量=$\frac{0.224L}{22.4L/mol}$=0.01mol,反应为Cl2+2NaOH=NaCl+NaClO+H2O,氯元素化合价0价变化为-1价和+1价,1mol氯气反应电子转移1mol,0.01mol氯气反应电子转移0.01mol;
(4)氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性.
解答 解:(1)e处产生黄绿色气体,说明生成氯气.由于有氯化锰生成,根据原子守恒还生成水,反应方程式为:2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O,离子方程式为2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O,该反应中发生反应的氧化剂和还原剂的物质的量之比为1:5,故答案为:2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O;1:5;
(2)b处氯气能置换出碘,碘遇淀粉变蓝色,故答案为:溶液由无色变为蓝色;
(3)氯气与氢氧化钠反应生成氯化钠和次氯酸钠,反应的方程式为Cl2+2NaOH═NaCl+NaClO+H2O,标准状况下,当有0.224L Cl2被NaOH溶液吸收后,氯气物质的量=$\frac{0.224L}{22.4L/mol}$=0.01mol,反应为Cl2+2NaOH=NaCl+NaClO+H2O,氯元素化合价0价变化为-1价和+1价,1mol氯气反应电子转移1mol,0.01mol氯气反应电子转移0.01mol;
故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;0.01mol;
(4)氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,由e处反应可知氧化性为KMnO4>Cl2,由d处反应可知氧化性为Cl2>FeCl3,则氧化性由强弱顺序为KMnO4>Cl2>FeCl3,故答案为:能;KMnO4>Cl2>FeCl3.
点评 本题以氯气的性质为载体考查学生氧化还原反应的有关知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握相关物质的性质,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
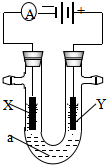 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4与足量稀 HNO3 反应:Fe3O4+8H+=2Fe3++Fe2++4H2O | |
| B. | 用小苏打治疗胃酸过多:NaHCO3+H+=Na++CO2↑+H2O | |
| C. | 双氧水中加入稀硫酸和 KI 溶液:H2O2+2H++2I-=I2+2H2O | |
| D. | 往碳酸氢钙溶液中滴入少量氢氧化钠溶液:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| C. | 向NaAlO2溶液中通人过量CO2制Al(OH)3:AlO2-+CO2+H2O═Al(OH)3↓+HCO3- | |
| D. | 向含2molAlCl3的溶液中加入1L 7mol/L的NaOH溶液:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2是一种黄绿色、有刺激性气味、有毒的气体 | |
| B. | Cl2能使湿润的红色布条褪色 | |
| C. | Fe在Cl2中燃烧,生成的产物为FeCl2 | |
| D. | 实验室用加热二氧化锰和浓盐酸的方法制取Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| 完全沉淀的PH | 10.5 | 4.3 | 5.3 |
| 开始溶解的pH | -- | 7.8 | 9.2 |
| Ksp近似值 | 10-12 | 10-14 | 10-31 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相同的①CH3COONa、②NaHCO3、③C6H5ONa,三份溶液中的c(Na+):③>②>① | |
| B. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)═2c(A2-)+c(HA-)+c(H2A) | |
| C. | 在电解食盐水的实验中,若电解后溶液总体积为1L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为12 | |
| D. | 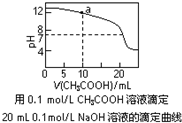 如图中a点溶液中各离子浓度的关系是:c(OH-)═c(H+)+c(CH3COO-)+2c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com