
在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气.下列说法正确的是()
A. 甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大
B. 甲烧杯中的酸过量
C. 乙烧杯中的锌有剩余
D. 反应开始后乙烧杯中的C(H+)始终比甲烧杯中的c(H+)小
考点: 弱电解质在水溶液中的电离平衡.
专题: 电离平衡与溶液的pH专题.
分析: A.醋酸浓度大,消耗的Zn多,但产生等量的氢气时,醋酸消耗的Zn少;
B.两种溶液的体积和pH都相等,HCl的浓度小;
C.盐酸的浓度小,生成等量的氢气,盐酸完全反应;
D.反应开始后,醋酸持续电离.
解答: 解:A.在体积和pH都相等的盐酸和醋酸中,已提供的H+的浓度和其物质的量相等,但由于醋酸是弱酸,只有部分电离;盐酸是强酸,已经完全电离,所以可提供的H+的物质的量显然是醋酸大于盐酸,与足量的锌反应时,消耗锌的质量是醋酸大于盐酸将大于盐酸,所以在醋酸中加入的锌粒质量应较小,盐酸中加入的锌粒质量较大,故A正确;
B.当加入的锌粒质量不等而产生等量的氢气时,说明参加反应的锌粒相等,乙烧杯中醋酸一定有剩余度,故B错误;
C.盐酸一定无剩余(盐酸中锌粒当有剩余),否则不可能产生等质量的氢气,故C错误;
D.由于醋酸还能继续电离而盐酸不能,所以反应开始后,醋酸中的H+浓度大于盐酸中的氢离子浓度,则反应开始后乙烧杯中的C(H+)始终比甲烧杯中的c(H+)大,故D错误;
故选A.
点评: 本题考查弱电解质的电离与酸与金属的反应,明确浓度与氢离子的关系,氢气与金属的质量关系是解答本题的关键,题目难度不大,但属于易错题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
有一溶液可能含有SO42一、Br﹣、H2SO3、NH4+等微粒,对该溶液进行实验:不能确定在原溶液中一定存在的微粒是()
①取少量溶液加热,放出的气体可以使品红溶液褪色;
②取原溶液加碱液使溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝;
③取原溶液加氯水,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸.
A. SO42﹣ B. Br﹣ C. H2SO3 D. NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色澄清溶液中可能含有以下离子中的若干种:
Na+、Cu2+、Ba2+、Fe2+、SO42-、Cl-、Br-现取部分溶液依次进行如下实验:
①通入 一定量氯气后,加入CCl4振荡,静置后CCl4层呈橙红色,用分液漏斗分液;
一定量氯气后,加入CCl4振荡,静置后CCl4层呈橙红色,用分液漏斗分液;
②向分液后的水溶液中加入足 量硫酸钠溶液,产生白色沉淀;
量硫酸钠溶液,产生白色沉淀;
③过滤后将滤液分为两份,向一份中加入硝酸酸化的硝酸银溶液,产生大量沉淀;根据上述实验,以下推测正确的是 ( )
A.原溶液中肯定存在的离子有Ba2+、Br-、Fe2+ B.无法确定原溶液中是否存在Cl-、Na+、SO42-
C.原溶液一定显中性 D.原溶液中肯定不存在的离子有Ba2+、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关CuSO4溶液的叙述正确的是 ( )
A.该溶液中Na+、NH4+、NO3-、Mg2+可以大量共存
B.通入CO2气体产生蓝色沉淀
C.与H2S反应的离子方程式:Cu2++ S2-=CuS↓
D.与过量浓氨水 反应的离子方程式:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
反应的离子方程式:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列指定反应的离子方程式正确的是 ( )
A.Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
常温时,将pH=3的H2SO4溶液和pH=12的NaOH溶液混合,当混合溶的pH=10时,强酸和强碱的体积之比为()
A. 1:9 B. 9:1 C. 10:1 D. 1:10
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质一定属于同系物的是()
①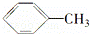 ②
② ③
③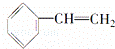 ④C2H2 ⑤CH2═CH﹣CH═CH2 ⑥C3H6
④C2H2 ⑤CH2═CH﹣CH═CH2 ⑥C3H6
⑦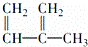 ⑧
⑧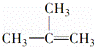
A. ①和② B. ④和⑥ C. ①和③ D. ⑤和⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com