
【题目】硼酸(H3BO3)大量应用于玻璃制造业,以硼镁矿(2MgO·B2O3·H2O、SiO2及少量Fe3O4、CaCO3, Al2O3)为原料生产硼酸的工艺流程如下:
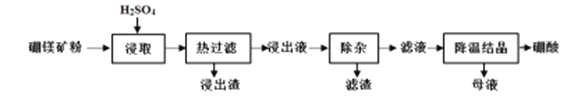
已知:ⅰ.Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4。
ⅱ.H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g。
(1)为了提高硼镁矿粉的浸出率,可采取的措施有 (至少答两条)
(2)“浸出液”显酸性,含H3BO3和Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO, H2O2的作用是 (用离子方程式表示),MgO除去的杂质离子是 。
(3)已知H3BO3与过量的NaOH反应生成Na[B(OH)4],试写出H3BO3在溶液中的电离方程式 。
(4)“浸取”后,采用“热过滤”的目的是 ,母液中的主要溶质有 。
(5)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4·H2O,应采取的 措施是将“母液”蒸发浓缩,____________
(6)测定所得产品的纯度:取ag 硼酸,小心加热使其分解脱去水分(杂质受热不分解),得残留固体bg,则产品的纯度为 。
【答案】
(1)加热、搅拌、将矿石粉碎或适当提高硫酸的浓度等;
(2)H2O2+2 Fe2++2H+=2 Fe3++2H2O;Fe3+和Al3+
(3)H3BO3+H2O![]() [B(OH)4]-+H+
[B(OH)4]-+H+
(4)防止硼酸从溶液中析出,影响产量;H3BO3 MgSO4
(5)加压升温结晶;
(6)![]() ×100%;
×100%;
【解析】
试题分析:由流程可知,加硫酸溶解只有SiO2不溶,CaO转化为微溶于水的CaSO4,趁热过滤,防止H3BO3从溶液中析出,“除杂”需先加H2O2溶液,将亚铁离子转化为铁离子,再加入MgO调节溶液的pH约为5.2,使铁离子、铝离子均转化为沉淀,则滤渣为氢氧化铝、氢氧化铁,然后蒸发浓缩、冷却结晶、过滤分离出H3BO3。
(1)为了提高硼镁矿粉的浸出率,可采取的措施有加热、搅拌、将矿石粉碎或适当提高硫酸的浓度等,故答案为:加热、搅拌、将矿石粉碎或适当提高硫酸的浓度等;
(2)加适量H2O2把Fe2+氧化为Fe3+,所以H2O2的作用是:H2O2+2H++2Fe2+=2Fe3++2H2O,加MgO调节PH,使Fe3+、Al3+转化为沉淀而除去,所以除去的离子有Fe3+、Al3+,故答案为: H2O2+2H++2Fe2+=2Fe3++2H2O;Fe3+、Al3+;
(3)H3BO3与过量的NaOH反应生成Na[B(OH)4],说明H3BO3是一元酸,H3BO3在溶液中的电离方程式为H3BO3+H2O![]() [B(OH)4]-+H+,故答案为:H3BO3+H2O
[B(OH)4]-+H+,故答案为:H3BO3+H2O![]() [B(OH)4]-+H+;
[B(OH)4]-+H+;
(4)由题目信息可知:H3BO3的溶解度随温度的升高而增大,所以要采用“热过滤”,以防温度下降时H3BO3从溶液中析出,母液中的主要溶质有H3BO3 MgSO4,故答案为:防止温度下降时H3BO3从溶液中析出影响产量;H3BO3 MgSO4;
(5)根据图2可知,温度越高MgSO4H2O的溶解度越小,由于溶液的沸点随压强增大而升高,为了防止溶液沸腾,应该在较高的压强条件下加热,使MgSO4H2O结晶析出,故答案为:加压升温结晶;
(6)硼酸加热分解脱水生成B2O3,水的质量为(a-b)g,物质的量为![]() =
=![]() mol,根据H元素守恒,硼酸的质量为
mol,根据H元素守恒,硼酸的质量为![]() ×
×![]() mol×62g/mol=
mol×62g/mol=![]() g,硼酸的纯度为[
g,硼酸的纯度为[![]() g÷ag] ×100%=
g÷ag] ×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】生活中处处有化学,下列表述不正确的是( )
A.严禁乱弃废电池,防止重金属污染土壤和水源
B.皮肤沾有油脂时,立即用氢氧化钠稀溶液擦洗
C.硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料
D.用含橙色酸性重铬酸钾的仪器检验酒驾,利用了乙醇的挥发性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15g·cm-3的混合溶液。计算:
(1)混合后溶液的质量分数___________。
(2)混合后溶液的物质的量浓度_____________。
(3)在1000g水中需溶解_____________摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R为1~18号元素,其原子所具有的电子层数为最外层电子数的![]() ,它可能形成的
,它可能形成的
含氧酸根离子有:①RO32-,②RO42-,③R2O32-,下列叙述判断正确的是
A. 当它可以形成①时,不可能形成③ B. 当它形成①时,也可以形成②和③
C. 当它可以形成②时,不可能形成③ D. 当它可以形成①时,不可能形成②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生物体内化学元素的叙述错误的是
A. 活细胞中含量最多的无机物与含量最多的有机物中均含H、O
B. 蛋白质中的N主要存在于肽键中
C. 细胞内微量元素作用能被其它元素替代
D. 生物体内的化学元素均能在无机环境中找到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组欲通过实验方法验证Fe2+的某些性质。
(1)在实验前,依据Fe2+的 性,填写了下表。
实验操作 | 预期现象 | 反应的离子方程式 |
向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+ =Fe3++NO2↑+H2O |
依照表中操作,该同学进行实验。观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色。
(2)分别取少量反应后的溶液于两只试管中,一只滴加几滴KSCN溶液,溶液变为红色,则溶液中含有 ;另一只试管滴加几滴 溶液,产生蓝色沉淀,则含有Fe2+。
(3)该小组讨论认为深棕色可能是NO2或NO与铁的某一种离子发生反应引起的。
提出猜想:
i.NO2与Fe2+发生反应 ⅱ.NO2与Fe3+发生反应
ⅲ.NO与Fe2+发生反应 ⅳ.
(4)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的。为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究。
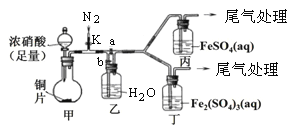
步骤 | 操作及现象 | 解释或结论 |
① | 关闭k、b,打开a,开始甲中反应一段时间后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化。 | 溶液深棕色由 与NO或NO2反应而得到。 |
② | 停止甲中反应,打开活塞k、b、关闭a,持续通入N2一段时间。 | 该操作的目的是 |
③ | 更换新的丙、丁装置,再这一段时间N2后关闭k,使甲中反应继续,观察到的现象与步骤①中相同。 | 乙瓶中发生的化学方程式为 。 |
(5)结合实验猜想,得出结论:
溶液呈深棕色的原因,肯定成立的是猜想 ;不确定的是猜想 ,有待后续实验进一步探究。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列说法中错误的是
A.14g乙烯和甲烷混合气体中的氢原子数一定大于2NA
B.2molN2与6molH2在一定条件下反应生成的NH3分子数一定大于2NA
C.56gFe溶于过量稀硝酸,电子转移数一定等于3NA
D.标准状况下,2.24LCH3Cl含有的共价键数一定等于0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com