
【题目】管道工人曾经用浓氨水检查氯气管道是否漏气,发生反应:8NH3+3Cl2=6NH4Cl+N2。下列叙述正确的是( )
A.NH3的电子式为![]()
B.每转移3NA电子时,消耗Cl2的体积为33.6L
C.该检验过程有共价键、离子键的断裂与生成
D.用该方法检验管道泄漏处会产生白烟
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图是实验室制取乙烯,并用来验证乙烯化学性质的实验装置,其中B中盛放的是溴水,C中盛放的是酸性KMnO4溶液。
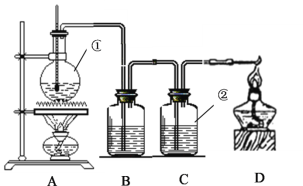
(1)写出①中发生反应的化学方程式____________________________________,
(2)B瓶中的现象是__________________,C瓶中的现象是__________________,这两种现象可以证明乙烯是_____________。(填“饱和烃”或“不饱和烃”)
(3)写出B瓶中发生反应的方程式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
一定条件下,在2L密闭容器内,反应2NO2![]() N2O4,n(NO2)随时间变化如表:
N2O4,n(NO2)随时间变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
用NO2表示0~2s内该反应的平均反应速率___。在第5s时,NO2的转化率为___。根据表中可以看出,随着反应进行,反应速率逐渐减小,其原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关滴定的说法正确的是( )
A. 用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
B. 用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中有NaOH杂质,则结果偏低
C. 用C1mol/L酸性高锰酸钾溶液滴定V2mL未知浓度的H2C2O4溶液,至滴定终点用去酸性高猛酸钾溶液体积为V1mL,则H2C2O4溶液的浓度为![]() mol/L
mol/L
D. 用未知浓度的盐酸滴定已知浓度的NaOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
(1)取冰醋酸配制250mL 0.4 mol·L-1的醋酸溶液,用0.4mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
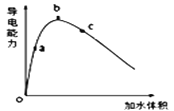
①将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。则稀释过程中溶液的pH由大到小的顺序____(填字母)。
②为标定该醋酸溶液的准确浓度,用0.2000mol·L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
该醋酸溶液的准确浓度为_____________(保留小数点后四位),上述标定过程中,造成测定结果偏高的原因可能是_____________(多选、错选不得分)。
a.未用标准液润洗碱式滴定管
b.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
c.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
d.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
(2)该小组同学探究浓度对醋酸电离程度的影响时,用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度( mol·L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
①根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是___________。
②简述用pH试纸测 0.1mol·L-1 醋酸溶液pH的方法___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸(结构如图所示)为柳树皮提取物之一,是一种天然的消炎药,主要作为医药工业的原料。下列关于水杨酸的叙述错误的是( )
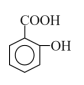
A.分子式为C7H6O3
B.能发生加成、酯化、中和等反应
C.苯环上的二氯取代物有5种
D.所有原子均可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下将2mol SO2和1mol 18O2 充入恒容密闭容器中发生反应:2SO2(g)+18O2 (g) ![]() 2SO3(g) ,达到化学平衡后,下列说法不正确的是
2SO3(g) ,达到化学平衡后,下列说法不正确的是
A.18O 存在于SO2、O2 和SO3 中B.容器中所含氧原子总数为6 NA
C.反应中转移电子的数目为4 NAD.平衡后再充入一定量Ar,重新平衡后,SO3浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科学家团队通过镁热还原法将天然的硅藻土转化为具有多级孔道结构的硅框架,并将该硅框架与熔融态的锂金属混合制成具有多孔结构的复合锂金属。一种全固态锂金属电池是以复合锂金属为a极,磷酸铁锂为b极,聚环氧乙烷基聚合物(PEO-SPE)为固态电解质(如图所示),该电池的总反应为:LiFePO4![]() xLi+Li1-xFePO4。下列说法不正确
xLi+Li1-xFePO4。下列说法不正确
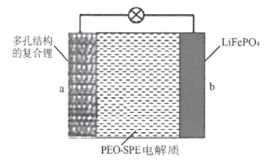
A.放电时Li+通过固态电解质向b极移动
B.多孔结构的复合锂金属有利于锂金属的均匀沉积和脱出
C.充电时,b极反应为:Li1-xFePO4+xe-+xLi+=LiFePO4
D.充电时,当a极质量增加mg时,理论上b极质量减少mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
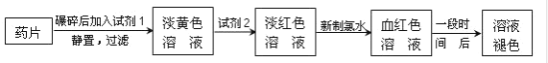
试回答下列问题:
(1)试剂1是__,试剂2是__,加入新制氯水后溶液中发生的离子反应方程式是__、_____。
(2)加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为__,写出+2价Fe在空气中转化为+3价Fe的化学方程式__。
(3)该同学猜想红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?__。若你认为合理,请说明理由(若你认为不合理,该空不作答);若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不作答)___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com