
【题目】下列化学用语正确的是
A. HSO3-+ H2O![]() SO32- + OH- B. Al3+ + 3H2O == 3H+ + Al(OH)3↓
SO32- + OH- B. Al3+ + 3H2O == 3H+ + Al(OH)3↓
C. NaHCO3 == Na+ + HCO3- D. H2S![]() 2H+ + S2-
2H+ + S2-
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(Ⅰ)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知A和B原子具有相同的电子层数,且A元素的最高正价与最低负价和为零,C是同周期中原子半径最大的元素,D是同周期中离子半径最小的元素。C的单质在加热条件下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物F。试根据以上叙述回答:
(1)D元素在周期表中位置为_____________________;
(2)画出E的离子结构示意图_____________;写出ABE分子的结构式____________;
(3)工业上常用在微波条件下用A单质与EB2反应来解决其产生的环境问题,写出该化学方程式:___________________________________________;
(4)用电子式表示C2E的形成过程__________________________________________;
(5)1 mol C与A元素的最高价氧化物反应时转移的电子数为_________。
(Ⅱ)、某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回答下列问题:
(1)按右图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器b的名称是_________;实验过程中,装置B中观察的现象是___________;装置C中有白色沉淀生成,该沉淀是__________(填化学式)。

(2)装置A反应容器中还会产生CO2气体,请写出产生CO2的化学方程式__________。
(3)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置连接A装置中c处管口,从左到右的顺序为__________(填序号);然后再进行的操作是从a处多次鼓入N2,其目的是__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度为T时,向2.0 L恒容密闭容器中充入1.0 molA和1.0 molB,发生反应A(g)+B(g)![]() C(g),一段时间后达到平衡。测定得部分数据见下表:
C(g),一段时间后达到平衡。测定得部分数据见下表:
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
(1)反应前5 s的平均反应速率v(A)=____________。
(2)温度为T时,达到平衡后B物质的量的浓度=________。
(3)升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH_______0(填“>”或“<”)。
(4)下列措施能增大反应速率,且平衡向正反应方向移动是__________。
a.及时分离出A气体 b.适当升高温度 c.增大B的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等.下列叙述不正确的是
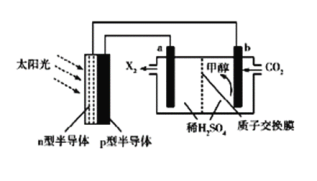
A. b极的电极反应式为CO2+6e-+6H+=CH3OH+H2O
B. n型半导体为负极
C. X2为O2,H+由b极向a极移动
D. 当制备32g甲醇时,质子交换膜两侧溶液相差104g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用化学沉降法处理酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在),同时从沉渣中还可以提取出常用的中药药剂As2O3,基本实现了废水处理过程的“三废”零排放。工艺流如下:

回答下列问题:
(1)H3AsO3中,砷元素的化合价为__________
(2)H3AsO3是三元弱酸,第一步和第二步电离是通过和水中的OH-结合实现的,第三步则直接电离出H+,第一步电离方程式为H3AsO3+H2O![]() [As(OH)4]-+H+,则第二步电离方程式为________________________________。
[As(OH)4]-+H+,则第二步电离方程式为________________________________。
(3)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) ![]() 2AsS33-(aq); “一级沉砷”中FeSO4的作用是___________________________________________________
2AsS33-(aq); “一级沉砷”中FeSO4的作用是___________________________________________________
(4)“二级沉砷”后,滤渣A的主要成分,除含有Ca3(AsO4)2 、FeAsO4、Fe(OH)3外,还有________(写化学式)。
(5)写出Ⅳ过程中,由Na3AsO4制备As2O3 的离子方程式 ____________________________ 。
(6)砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 , K2=1.7×10-7 , K3=4.0×10-12, Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O![]() HAsO42-+OH-,该步水解的平衡常数(25℃)为__________(保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为__________(保留两位有效数字)。
(7)雌黄(As2S3)和雄黄(As4S4 )是自然界中常见的砷化物,一定条件下,两者的转化关系如下图所示。若反应Ⅱ中,1mol As4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
分别如下,其中反应速率最大的是( )
A.v(C)=0.04 mol/(L·s)
B.v(B)=0.06 mol/(L·min)
C.v(A)=0.15 mol/(L·min)
D.v(D)=0.01 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌溴液流电池是一种新型电化学储能装置(如下图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法正确的是( )
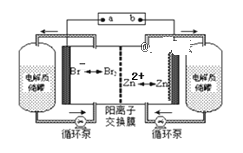
A. 充电时阴极的电极反应式为:Br2+2e-=2Br-
B. 放电时每转移2mol电子,负极区质量减少65克
C. 放电时左侧电解质储罐中的离子总浓度增大
D. 充电是b接电源的正极,Zn2+通过阳离子交换膜由左侧流向右侧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种易溶于水难溶于有机溶剂的气体,在自来水消毒和果蔬保鲜等方面应用广泛。某同学在实验室中制取ClO2,并探究其性质。回答下列问题:
Ⅰ.ClO2的制备
实验室制备ClO2的反应原理为2NaClO2 + Cl2 = 2ClO2 + 2NaCl,装置如下图所示:

(1)装置A烧瓶中发生反应的离子方程式为___________________________。
(2)装置B中盛放的最佳试剂为________(填字母代号);
a.NaOH溶液 b.浓硫酸 c.饱和食盐水 d.CCl4 e.饱和石灰水
(3)控制滴加浓盐酸的速率,使产生的气体缓缓通过装置D,其目的是______________________________________________________________。
Ⅱ.探究ClO2的氧化性,按下图所示装置进行实验:

(4)完成下列表格中的空格:
洗气瓶 | 现象或作用 | 解释原因 |
X | 溶液由浅绿色变成棕黄色 | 反应的离子方程式为_________________ |
Y | 溶液中出现淡黄色沉淀 | 反应的离子方程式为______________ |
Z | NaOH溶液的作用是________________________ | 反应的化学方程式为 2NaOH + 2ClO2 = NaClO2 + NaClO3 + H2O |
Ⅲ.测定水中的浓度
用碘量法测定水中ClO2浓度的实验步骤:取100 mL的水样加稀硫酸调节pH至2~3,加入一定量的KI溶液,充分振荡后,再加入几滴指示剂,用2.0×10-4 mol/L标准Na2S2O3溶液进行滴定(已知:2ClO2 + 10I- + 8H+ = 5I2 + 2Cl- + 4H2O ;2S2O32- + I2 = S4O62- + 2I- )。
(5)若达到滴定终点时,消耗15.00 mL 标准Na2S2O3溶液,则水样中ClO2的浓度是 _________ mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com