
【题目】设氯原子的质量为ag,12C原子的质量为bg,用NA表示阿伏加德罗常数的值,则下列说法不正确的是( )
A.该氯原子的相对原子质量为![]() B.mg该氯原子的物质的量为
B.mg该氯原子的物质的量为![]() mol
mol
C.该氯原子的摩尔质量是aNAgD.ng该氯原子所含的电子数是![]()
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟工业制漂白粉,设计了如下图所示的实验装置。

已知:
①氯气和碱反应放出热量。
②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O
请回答下列问题。
(1)甲装置中仪器a的名称是___。
(2)圆底烧瓶内发生反应的化学方程式为___;装置乙中饱和食盐水的作用是___。
(3)装置丁中发生反应的离子方程式为___。
(4)漂白粉在空气中失效的原因是___、___(用化学方程式表示)。
(5)①该小组制得的漂白粉中n(CaCl2)远大于n[Ca(C1O)2],其主要原因是___。
②为提高Ca(ClO)2的含量,可采取的措施是___(任写一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2SO2(g) + O2(g) ![]() 2SO3(g) ΔH = a kJ/mol,能量变化如图所示。下列说法中,不正确的是( )
2SO3(g) ΔH = a kJ/mol,能量变化如图所示。下列说法中,不正确的是( )
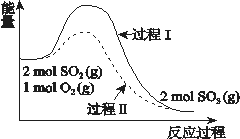
A. 2SO2(g) + O2(g) ![]() 2SO3(l) ΔH > a kJ/mol
2SO3(l) ΔH > a kJ/mol
B. 过程II可能使用了催化剂,使用催化剂不可以提高SO2的平衡转化率
C. 反应物断键吸收能量之和小于生成物成键释放能量之和
D. 将2molSO2(g) 和1mol O2(g)置于一密闭容器中充分反应后放出或吸收的热量小于┃a┃ kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中,下列电离方程式正确的是( )
A.CaCl2===Ca2++Cl2B.Na2SO4=== Na++![]()
C.HNO3=== H++![]() D.NaHCO3===Na++H++
D.NaHCO3===Na++H++![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟胺的电离方程式为:NH2OH+H2O![]() NH3OH++OH-(25℃时,Kb=9.0×10-9)。用0.lmol/L盐酸滴定20mL 0.lmol/L羟胺溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法错误的是( )
NH3OH++OH-(25℃时,Kb=9.0×10-9)。用0.lmol/L盐酸滴定20mL 0.lmol/L羟胺溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法错误的是( )
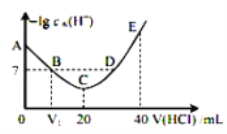
A.图中V1<10
B.A点对应溶液的pH=9.5
C.A、B、C、D四点中酸性最强的点为D点
D.E点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。请回答下列问题:
(1)移取10.00 mL密度为ρg·mL-1的过氧化氢溶液至250mL______(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,请写出其反应的离子方程式_______。
(3)滴定时,将高锰酸钾标准溶液注入_______(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是________。
(4)重复滴定三次,平均耗用c mol·L-1KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为_________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_______(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)具有强氧化性,受热易分解,可作漂白剂、食品消毒剂等。
Ⅰ.亚氯酸钠的制备
以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:

(1)提高“反应1”反应速率的措施有__________________(答出一条即可)。母液中溶质的主要成分是___________(填化学式)。
(2)每有1mol SO2参加反应,理论上可生成ClO2的物质的量为________mol。
(3) “反应2”的化学方程式为_____________________________________。
(4)采取“减压蒸发”而不用“常压蒸发”,原因是____________________。
(5)“反应2”中使用H2O2而不用其他物质的原因是____________________。
Ⅱ.亚氯酸钠的应用
(6)用亚氯酸钠作水处理剂,水中可能残留少量亚氯酸钠,可以加入硫酸亚铁除去残留的亚氯酸盐,硫酸亚铁除可与亚氯酸钠反应外,还可以起到的作用是____________。
(7)实验室可用亚氯酸钠和氯酸钠在酸性条件下反应制备ClO2气体。写出上述反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一个体积可变的密闭容器中充入2 mol的气体A和1 mol的气体B发生反应:2A(g)+B(g)![]() 3C(g) ΔH>0。t1时刻反应达到平衡,并测得C在容器中的体积分数为φ1。t2时刻改变某一条件(其他条件不变),C在容器中的体积分数的变化如图所示,则t2时刻改变的条件是( )
3C(g) ΔH>0。t1时刻反应达到平衡,并测得C在容器中的体积分数为φ1。t2时刻改变某一条件(其他条件不变),C在容器中的体积分数的变化如图所示,则t2时刻改变的条件是( )

A. 加入1 mol氦气
B. 加入1 mol B
C. 增大压强
D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关说法正确的是
A.常温常压下,1.8g甲基(—CD3)中含有的电子数为NA
B.0. lmol环氧乙烷(![]() )中含有的共价键数为0. 3 NA
)中含有的共价键数为0. 3 NA
C.常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9 NA
D.加热条件下,含0.2molH2SO4的浓硫酸与足量铜反应,转移电子数小于0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com