
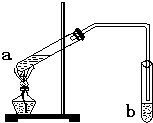
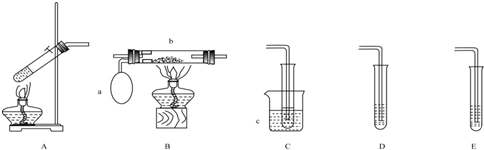
 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.请回答下列问题:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.请回答下列问题:分析 (1)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(2)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
(3)导管伸入液面下可能发生倒吸.
解答 解:(1)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+C2H5OH CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(2)吸收乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;
故答案为:中和乙酸、吸收乙醇,降低乙酸乙酯的溶解度,有利于酯的分离;
(3)乙酸和乙醇易溶于水,导管要插在饱和碳酸钠溶液的液面上,否则伸入液面下可能发生倒吸,
故答案为:防止倒吸.
点评 本题考查了乙酸乙酯的制备方法,题目难度中等,注意掌握乙酸乙酯的反应原理及制备方法,浓硫酸、饱和碳酸钠溶液、长导管在酯化反应中的作用为考查的热点,要求学生熟练掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
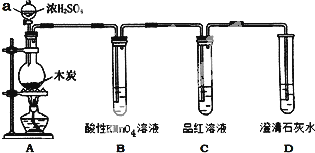
根据下列实验操作和现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 将某溶液与稀盐酸反应产生的气体通入澄清石灰水 | 石灰水变浑浊 | 该溶液中一定含有CO |
B | 将干燥的Cl2通过有色鲜花 | 鲜花褪色 | Cl2有漂白性 |
C | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生气体 | Na2O2没有变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
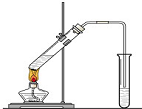 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
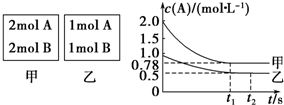
| A. | 降低体系温度能加快该反应的速率 | |
| B. | 0~2S内用O2表示该反应的平均反应速率为0.15mol/(L•s) | |
| C. | 增大SO3的浓度能减慢该反应速率 | |
| D. | 反应一段时间后可生成4molSO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com