
����Ŀ���±�ΪԪ�����ڱ���һ����

��1���ݢޢߢ������Ӱ뾶�ɴ�С��˳��Ϊ______________________�������ӷ��ű�ʾ����
��2��������γɵ�һ�ֻ�����ÿ��ԭ������㶼����8e-�ṹ��д���û�����ĵ���ʽ________��
��3���٢�����Ԫ����ԭ�Ӹ�����Ϊ3:1�γɵ�һ�ֻ����д�������ȡ����Ľṹ��ʽ��_____��
��4�����ͬ�����Ԫ�صĻ�����������H3PO3�Ƕ�Ԫ���ᣬд��H3PO3�������NaOH��Һ��Ӧ�����ӷ���ʽ__________________________________��
��5���ɢܢ�����Ԫ����ɵ�һ�ֻ�������뵽����������Һ�У��������ɫ�������������������д���÷�Ӧ�����ӷ���ʽ__________________________________��
���𰸡� �� �� �� �� ��
�����������Ԫ�����ڱ���֪����ΪH����ΪC����ΪN����ΪO����ΪF����ΪNa����ΪAl����ΪSi����ΪS����ΪCl��
��1��F-��Na+��Al3+�����ӽṹ�Ų���ͬ��S2-��Cl-�����ӽṹ�Ų���ͬ��ͨ�����ӽṹ�Ų���ͬʱ�˵����Խ�����Ӱ뾶ԽС���������Ӻ�����Ӳ����࣬���Ӱ뾶�������Ӱ뾶�ɴ�С��˳��ΪS2->Cl->F->Na+>Al3+ ��
��2��N��Cl�γɵ�һ�ֻ�����ÿ��ԭ�������Ӷ�����8e�ṹ��˵��Nԭ�ӷֱ���������ԭ���γ��������Ӷԣ��û�����ĵ���ʽΪ![]() ��
��
��3��H��C����Ԫ����ԭ�Ӹ�����3��1�γɵ�һ�ֻ�����ΪC2H6�������ȡ���ﹲ��2�֣����ǵĽṹ��ʽ�ֱ�ΪCH3CHCl2 �� CH2ClCH2Cl��
��4��������H3PO3�Ƕ�Ԫ���ᣬ˵����������ɵ����2��H������H3PO3�������NaOH��Һ��Ӧ�����ӷ���ʽΪH3PO3+2OH-=2H2O+HPO32- ��
��5����Na��O����Ԫ����ɵ�һ�ֻ�������뵽����������Һ�У��������ɫ����4Fe(OH)3��˵���˻�������ǿ�����ԣ�ӦΪNa2O2�������������������ݵ����غ�͵���غ㣬��֪�÷�Ӧ�����ӷ���ʽΪ3Na2O2+6Fe2++6H2O=6Na+ +4Fe(OH)3��+2Fe3+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�еĵ绯ѧװ���Լ״�(CH3OH)Ϊ��Ҫԭ�Ϻϳ�̼�������[(CH3O)2CO]�����˵���������
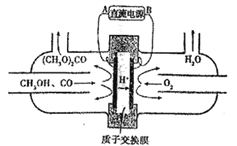
A. B��ֱ����Դ�ĸ���
B. ̼���������̼��Ϊ+4��
C. ����������ҺpH����
D. ÿ����2molH+ͨ�����ӽ���Ĥ����������������ڱ�״����Ϊ11.2L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X2����Y+���Ӷ���Arԭ�Ӿ�����ͬ�ĺ�������Ų�����������������ȷ���ǣ� ��
A.ԭ������X��Y
B.���Ӱ뾶X��Y
C.X��Yһ����ͬһ����
D.X�ǵ�IIA��Ԫ�أ�Y�ǵ�VIIA��Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��X��Y��Z��W��ԭ������������������Ԫ���γɵĵ�������Ϊm��n��p��q��r��t��u����ЩԪ����ɵĶ�Ԫ���������uΪ�γ��������Ҫ����֮һ��25��ʱ��0.01mol��L-1��v��Һ�У�c��OH-��/c��H+��=1.0��1010���������ʵ�ת����ϵ��ͼ��ʾ������˵����ȷ����

A. ԭ�Ӱ뾶�Ĵ�С��W>Z>Y>X
B. Z�ֱ���Y��W��ɵĻ������л�ѧ�����Ϳ�����ͬ
C. v������ˮ�ĵ����u�ܴٽ�ˮ�ĵ���
D. ճ��q���Թܿ��þƾ�ϴ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ����Ni,����������Cu��Fe��Pb�ȡ��ִ�����ȡNi2O3,�����������������ǡ�����ɴ��ĸ��ܵ�أ�Ҳ�������Ƴ����Ӽ��Ե�ء��������̼��£�

��֪0.010mol/L���������ڲ�ͬpH�µij���������£�
Fe3+ | Cu2+ | Ni2+ | Fe2+ | |
��ʼ����pH | 3.0 | 5.0 | 7.4 | 9.7 |
��ȫ����pH | 4.0 | 6.5 | 9.0 | 11 |
�ش��������⣺
(1)����̼��Ƶ�pH��Ŀ����____________________________________________��������2������Ҫ�ɷ���____________�������ȹ��ˡ�����1�����ٽ��С���Cu����ԭ����______________________________________________________________________��
(2)�����ӷ���ʽ���ͼ���NH4F����Ca���Ĺ���_________________��
(3)�������ʱ���뷴Ӧ��H2SO4��HNO3���ʵ����ȱ���Ϊ3��2����ʱNi�����������Ļ�ѧ����ʽΪ___________________________________________��
(4)������X����__________��__________������ʱ������������ijɷ���________��
(5)��NiO�м��������ܽ⣬����ȫ�ܽ��������NaOH��Һ���ټ���NaClO��Һ��д�����к�NaClO��صķ�Ӧ�����ӷ���ʽΪ_________________________________��
(6)�����ϱ����ݣ����㵱0.010mol/LNiSO4��Һ��Ni2+��ȫ����ʱ��c(Ni2+)=______mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A.�Ȼ��ƿ������Ʊ�����
B.ʳƷ���г�������ʯ�ң�����������������
C.������չ����Դ�����ܼ�������Σ��
D.ʯ���ѻ���ú�ĸ����������Ҵ��������ʱ��Զ����ڻ�ѧ�仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. Na��H2O�ķ�Ӧ�������ķ��ȷ�Ӧ���÷�Ӧ���Է�����
B. ԭ����з����ķ�Ӧ�ﵽƽ��ʱ���õ����������
C. FeCl3��MnO2���ɼӿ�H2O2�ֽ⣬ͬ�������¶��߶�H2O2�ֽ����ʵĸı���ͬ
D. Mg(OH)2��������Һ�д���ƽ�⣺Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq)���������NH4Cl��Һ
Mg2+(aq)+2OH-(aq)���������NH4Cl��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�����ȿ���CO��CO2��Ӧ�öԹ�����̬������������Ҫ�����塣
��1��CO��������������֪��
Fe2O3(s)+3C(s)�T2Fe(s)+3CO(g)��H1=+489.0kJmol-1��
C(s)+CO2(g)�T2CO(g)��H2=+172.5kJmol-1
��CO��ԭFe2O3(s)���Ȼ�ѧ����ʽΪ__________��
��2�������¯ú���õ���CO���������Ƴ�ȼ�ϵ��(��KOH��ҺΪ���Һ)��д���õ�صĸ�����Ӧʽ��__________��
��3��CO2��H2����һ��������ܱ������У��������¶��·�����Ӧ��CO2(g)+3H2(g)CH3OH(g)+H2O(g) ���CH3OH�����ʵ�����ʱ��ı仯��ͼ1��
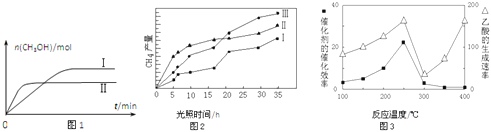
������I������Ӧ��ƽ�ⳣ����С��ϵΪK��__________K��(������������=����������)��
��һ���¶��£����ݻ���ͬ�ҹ̶��������ܱ������У������·�ʽ���뷴Ӧ�һ��ʱ���ﵽƽ�⡣
�� �� | �� | �� |
��Ӧ��Ͷ���� | 1molCO2��3molH2 | a molCO2��b molH2�� |
������ƽ��������ѹǿΪ��ʼ��0.8����Ҫʹƽ������������ͬ��ֵ����������ȣ�����ʼʱά�ֻ�ѧ��Ӧ���淴Ӧ������У���c��ȡֵ��ΧΪ__________��
��4�����ù��ܺ�������ɽ�CO2��H2O(g)ת��ΪCH4��O2�����������ʱ���ڲ�ͬ����(I��II��III)�����£�CH4���������ʱ��ı仯��ͼ2����0��15Сʱ�ڣ�CH4��ƽ����������I��II��III�Ӵ�С��˳��Ϊ__________(�����)��
��5����TiO2/Cu2Al2O4Ϊ���������Խ�CO2��CH4ֱ��ת�������ᡣ�ڲ�ͬ�¶��´����Ĵ�Ч����������������ʵĹ�ϵ��ͼ3��
�����������������Ҫȡ�����¶�Ӱ��ķ�Χ��__________��
��Cu2Al2O4������ϡ���ᣬд���йص����ӷ���ʽ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.5 LijŨ�ȵ�NaCl��Һ�к���0.5 mol Na+�����жԸ���Һ��˵���в���ȷ����
A. ��ȡ100 mL������Һ�����ʵ����ʵ���Ũ��Ϊ1 mol��L��1
B. ����Һ�к���29.25 g NaCl
C. ����100 mL����Һ����������ƽ��5.85 g NaCl
D. ��ȡ100 mL����Һ�����ձ���,�ձ���Na+�����ʵ���Ϊ0.1 mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com