
 (1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是
(1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
| OH- |
| H+ |
| OH- |
| H+ |


科目:高中化学 来源: 题型:
| A、加热 |
| B、加入少量K2SO4溶液 |
| C、用粗锌(含铜、银)而不用纯锌 |
| D、滴加少量CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应速率 |
| B、混合气体的密度保持不变 |
| C、混合气体的颜色保持不变 |
| D、混合气体的体积保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
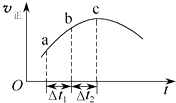 向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A、反应物的总能量低于生成物的总能量 |
| B、反应物浓度:a点小于b点 |
| C、△t1=△t2时,SO2的转化率:a~b段小于b~c段 |
| D、反应在c点达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 5 |
| 2 |
| A、10个电子转移时,该反应放出1300kJ的能量 |
| B、NA个水分子生成且为液体时,吸收1300kJ的能量 |
| C、有2NA个碳氧共用电子对生成时,放出1300kJ的能量 |
| D、有8NA个碳氧共用电子对生成时,放出1300kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeC13、NaNO3、Na2CO3、NaC1 |
| B、NaOH、MgSO4、Na2CO3、NaHSO4 |
| C、AgNO3、KNO3、KC1、NaBr |
| D、HC1、BaC12、NaOH、CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
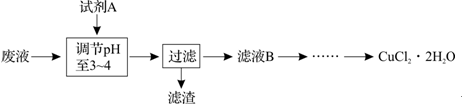
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 4.7 |
| 完全沉淀 | 4.1 | 9.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com