
【题目】实验发现,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )
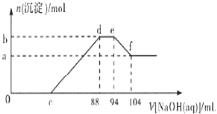
A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.c点对应NaOH溶液的体积为48 mL
C.b点与a点的差值为0.05 mol
D.样品中铝粉和铁粉的物质的量之比为5:3
【答案】B
【解析】
试题分析:铝粉和铁粉的混合物与一定量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了-3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有:①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,③NH4++OH-═NH3H2O,④Al(OH)3 +OH-=AlO2-+2H2O,B与A的差值为氢氧化铝的物质的量,由图可知,EF段消耗的氢氧化钠溶液为:104mL-94m=10mL,故该阶段参加反应的氢氧化钠为:0.01L×5mol/L=0.05mol,根据Al(OH)3 +OH-=AlO2-+2H2O可知,Al(OH)3的物质的量为0.05mol,根据铝元素守恒,故混合金属中n(Al)=0.05mol。由图可知DE段消耗的氢氧化钠的体积为:94mL-88mL=6mL,故该阶段参加反应的氢氧化钠为:0.006L×5mol/L=0.03mol,根据NH4++OH-═NH3H2O 可知,计算溶液中n(NH4+)=0.03mL,根据电子转移守恒有:3n(Fe)+3n(Al)=8n(NH4+),即3n(Fe)+3×0.05mol=8×0.03mol,解得:n(Fe)=0.03mol。由反应过程可知,到加入氢氧化钠为88mL时,溶液中溶质为硝酸钠与硝酸铵,n(NH4NO3)=n(NH4+)=0.03mol,根据钠元素守恒,可知n(NaNO3)=n(NaOH)=0.088L×5mol/L=0.44mol,根据氮元素守恒计算原硝酸溶液中n(HNO3)=n(NaNO3)+2n(NH4NO3)=0.44mol+0.03mol×2=0.5mol,而c点溶液为NaNO3、NH4NO3、Fe(NO3)3、Al(NO3)3,根据氮元素守恒n′(NaNO3)+2n(NH4NO3)+3n[Fe(NO3)3]+3n[Al(NO3)3]=n(HNO3),故C点溶液中n′(NaNO3)=0.5mol-0.03mol×2-0.03mol×3-0.05mol×3=0.2mol,故C点加入NaOH的物质的量为0.2mol。A.根据分析可知,稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵,故A正确;B.根据分析可知,C点对应NaOH溶液的体积=![]() =0.04L=40mL,故B错误;C.根据氮元素守恒计算原硝酸溶液中:n(HNO3)=n(NaNO3)+2n(NH4NO3)=0.44mol+0.03mol×2=0.5mol,故C正确;D.根据分析可知,混合金属中n(Al)=0.05mol、n(Fe)=0.03mol,样品中铝粉和铁粉的物质的量之比为5:3,故D正确;故选B。
=0.04L=40mL,故B错误;C.根据氮元素守恒计算原硝酸溶液中:n(HNO3)=n(NaNO3)+2n(NH4NO3)=0.44mol+0.03mol×2=0.5mol,故C正确;D.根据分析可知,混合金属中n(Al)=0.05mol、n(Fe)=0.03mol,样品中铝粉和铁粉的物质的量之比为5:3,故D正确;故选B。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①元素周期表中有7个横行,也就是7个周期
②元素周期表中有9个横行,分为7个周期
③元素周期表中有18个纵行,也就是18个族.
A.仅①
B.②③
C.①③
D.仅③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.1mol H2的质量只有在标准状况下才约为2g
B.标准状况下,22.4L氖气含有的原子数为2NA
C.标准状况下,18g水的体积约为22.4L
D.同温同压下,相同体积的气体单质含有的原子数目不一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境、工农业生产等密切相关,下列叙述正确的是
A.光化学烟雾与大量排放碳氢化合物和氮氧化合物有关
B.为防止臭氧空洞的扩大,联合国环保组织要求各国大量减少CO2的工业排放量
C.棉花、蚕丝和锦纶的主要成分都是纤维素
D.为了防止中秋月饼等富含脂食品氧化变质,延长保质期,可以包装袋中放入生石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应:3Cu+□HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,请填写□中的数字是 。铜是该反应的 剂,若有19.2g铜被氧化,参加反应的HNO3的物质的量是 mol,被还原的HNO3的物质的量是 mol,转移电子的数目为 (用NA表示)。用单线桥标出该反应中电子转移的方向和数目: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com