
| 10%+40% |
| 2 |


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
| A、氢原子获得一个电子也能变成稳定结构 |
| B、氢原子与氢离子都属于氢元素,它们的化学性质相同 |
| C、氦元素原子最外层有2个电子,故其化学性质稳定 |
| D、锂原子易失去最外层1个电子,形成最外层为2个电子的稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯水是混合物,漂白粉是纯净物 |
| B、SiO2是酸性氧化物,它能与强碱反应生成盐和水 |
| C、H2、NH3、SO2气体都可以用浓硫酸干燥 |
| D、NO2与水发生化合反应生成硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
| 0.1 mol?L-1 KI溶液 | H2O | 0.01mol?L-1 X 溶液 | 0.1 mol?L-1 双氧水 | 1 mol?L-1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验内容 | 实验现象(填入下栏) |
如右图,在一个100ml烧杯中,加入3~4药匙Na2CO3,粉末,用一张比烧杯口稍大,中部呈凹形的铁丝网,凹部放入疏松的脱脂棉包裹着的过氧化钠,向烧杯中加入适量3mol?L-1盐酸,立即把铁丝网放在烧杯上.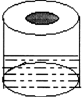 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com