
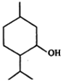
| A. | 薄荷醇分子中至少有12个碳原子共平面 | |
| B. | 薄荷醇分子式为C10H20O,它是环戊醇的同系物 | |
| C. | 1mol薄荷醇与足量NaHCO3反应生成22.4LCO2(标准状况) | |
| D. | 在一定条件下,薄荷醇能发生取代、中和、氧化等反应 |
科目:高中化学 来源: 题型:选择题
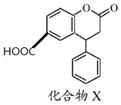
| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和NaHCO3溶液反应 | |
| C. | 化合物X可以由 和 和 通过酯化反应得到 通过酯化反应得到 | |
| D. | 1 mol化合物X最多能与3 molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯硫酸的摩尔质量为98 | |
| B. | 上述100mL稀硫酸中含溶质14g | |
| C. | 上述稀释过程所需要的蒸馏水为90mL | |
| D. | 质量分数为50%的硫酸物质的量浓度为7.14mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Na2S除去废水中的Hg2+ | B. | 用热的Na2CO3溶液去油污 | ||
| C. | 利用油脂的皂化反应制造肥皂 | D. | 配制CuSO4溶液时加少量稀H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
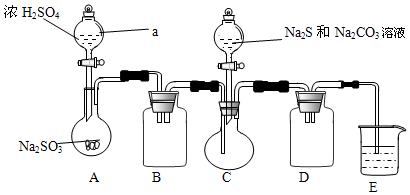
| 实验操作 | 现象 | 结论 |
| 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 | |
| 过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀HCl | 沉淀部分溶解,并有刺激性气味的气体产生 | 确定产品中含有Na2SO3和Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
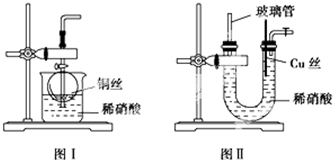
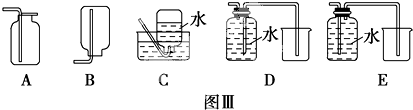
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
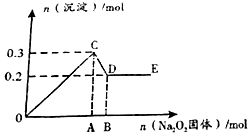 有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、SO42-、OH-中的一种或几种离子,取此溶液做下列实验.
有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、SO42-、OH-中的一种或几种离子,取此溶液做下列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究发现,NOx和SO2是雾霾的主要成分,已知:
研究发现,NOx和SO2是雾霾的主要成分,已知:| 化学式 | H2CO3 | H2SO3 |
| 电离平衡常数 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.54×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
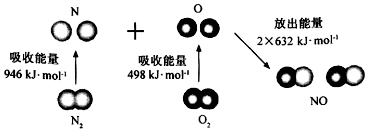
| A. | 直观看,该反应中反应物所具有的总能量低于生成物所具有的总能量 | |
| B. | 2 mol气态氧原子结合生成O2(g)时,能放出498 KJ能量 | |
| C. | 断裂1 mol NO分子中的化学键,需要吸收632KJ能量 | |
| D. | 该反应的热化学方程式为:N2+O2═2NO△H=+180KJ/mol. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com