
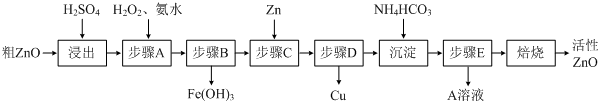
��15�֣�����ZnO�������ϡ�Ϳ�Ϲ�ҵ������ҪӦ�ã�һ���ɴ�ZnO����FeO��CuO���Ʊ�����ZnO���������£���֪����ʽ̼��п�����տ��Ƶû���ZnO����
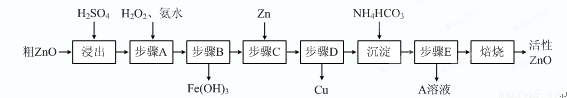
��֪�������������������������ʱ��pH���±���
|
���������� |
Fe2�� |
Fe3�� |
Zn2�� |
Cu2�� |
|
��ʼ����ʱpH |
6.34 |
1.48 |
6.2 |
5.2 |
|
��ȫ����ʱpH |
9.7 |
3.2 |
8.0 |
6.4 |
���ʴ��������⣺
�� ����A��H2O2������Ӧ�����ӷ���ʽ�� ���ò����������ҺpH�ķ�Χ�� ��
�� A��Һ����Ҫ���е������� ��
�� ��ʽ̼��п�������Ƶû���ZnO�ķ�Ӧ��H��0���÷�Ӧ���Է����е�ԭ���� ��
�� ����������ķ�ˮpH��8����ʱZn2����Ũ��Ϊ mg/L�������£�Ksp[Zn(OH)2]��1.2��10-17����
��1��2Fe2++H2O2+2H+=2Fe3++2H2O 3.2-5.2
��2��(NH4)2SO4 ��3���÷�Ӧ��һ����S��0�ķ�Ӧ ��4��0.78��ÿ��3�֣���15�֣�
����������1��������Ʒ�к��������������ʣ�������ͭ���ӵ�pH���ڳ���п���ӵ�pH�����Ա�������˫��ˮ������ͭ���ӣ�ת��Ϊ�����ӣ�Ȼ�����������ʽ��2Fe2++H2O2+2H+=2Fe3++2H2O���ò����Ŀ���dz��������ӣ������ܳ���ͭ���ӣ�����pH���ܸ���5.2������Χ��3.2��5.2��
��2������̼����淋�Ŀ���dz�����Һ�е�п���ӣ�����������п��������Һ�е���Ҫ����������李�
��3����Ȼ��Ӧ�����ȷ�Ӧ������ֵ��S����0�����Է�Ӧ�ǿ����Է��ġ�
��4��pH��8������Һ��OH��Ũ����10��6mol/L�����Ը����ܶȻ�������֪����Һ��п����Ũ����1.2��10-5mol/L�����1L��Һ�к���п������1.2��10-5mol��65g/mol��7.8��10-4g����Ũ����10.78mg/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���������� | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| ��ʼ����ʱpH | 6.34 | 1.48 | 6.2 | 5.2 |
| ��ȫ����ʱpH | 9.7 | 3.2 | 8.0 | 6.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ���������� | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| ��ʼ����ʱpH | 6.34 | 1.48 | 6.2 | 5.2 |
| ��ȫ����ʱpH | 9.7 | 3.2 | 8.0 | 6.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ���������� | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| ��ʼ����ʱpH | 6.34 | 1.48 | 6.2 | 5.2 |
| ��ȫ����ʱpH | 9.7 | 3.2 | 8.0 | 6.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�콭��ʡ�����ѧ����10�½���ϰ��ѧ�Ծ����������� ���ͣ������
��15�֣�����ZnO�������ϡ�Ϳ�Ϲ�ҵ������ҪӦ�ã�һ���ɴ�ZnO����FeO��CuO���Ʊ�����ZnO���������£���֪����ʽ̼��п�����տ��Ƶû���ZnO����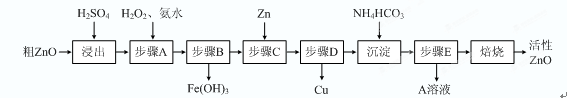
��֪�������������������������ʱ��pH���±���
| ���������� | Fe2�� | Fe3�� | Zn2�� | Cu2�� |
| ��ʼ����ʱpH | 6.34 | 1.48 | 6.2 | 5.2 |
| ��ȫ����ʱpH | 9.7 | 3.2 | 8.0 | 6.4 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com