
分析 Cu与浓硫酸发生Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,n(SO2)=$\frac{13.44L}{22.4L/mol}$=0.6mol,结合S元素的化合价变化计算转移电子,生成二氧化硫体现硫酸的氧化性,生成硫酸铜体现硫酸的酸性,以此来解答.
解答 解:向80mL浓硫酸中加入56g铜片,加热一段时间后至不再反应为止,发生Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;n(SO2)=$\frac{13.44L}{22.4L/mol}$=0.6mol,反应中转移电子为0.6mol×(6-4)=1.2mol;该反应中浓硫酸表现了酸性和强氧化性,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;1.2;酸;强氧化.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及转移电子的计算为解答的关键,侧重分析与计算能力的考查,注意硫酸的性质,题目难度不大.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
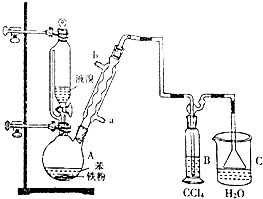
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能加快反应速率,使N2完全转化为NH3 | |
| B. | 当N2、H2、NH3浓度相等时,反应达到化学平衡状态 | |
| C. | 一段时间后,当N2、H2、NH3浓度不再改变时,反应物转化率最大 | |
| D. | 达平衡后,升高温度,反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (Q1+Q2+Q3) kJ | B. | 0.5(Q+Q2+Q3) kJ | ||
| C. | (0.5Q1-1.5Q2+0.5Q3) kJ | D. | -(3Q1-Q2+Q3) kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.9 mol/(L•s) | B. | v(B)=0.5 mol/(L•s) | C. | v(C)=1.4 mol/(L•s) | D. | v(D)=1.8 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
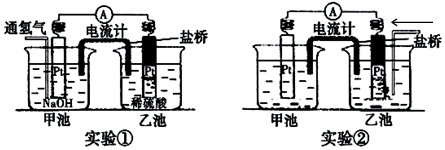
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将铜粉与硫粉混合均匀加热以制取CuS | |
| B. | 将铜丝插入浓硫酸中并加热,反应后再加水以观察CuSO4溶液的颜色 | |
| C. | 向CuSO4溶液中加入过量的NaOH溶液,过滤洗涤并收集沉淀充分灼烧以制取CuO | |
| D. | 向淀粉溶液中加入适量稀硫酸微热,再加少量新制Cu(OH)2并加热,产生砖红色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com