
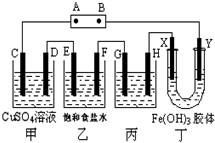
 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:分析 将电源接通后,向乙中滴入酚酞试液,在F极附近显红色,说明F极生成OH-,F为阴极,则可知A为正极,B为负极,C、E、G、X为阳极,D、F、H、Y为阴极,
(1)电解饱和食盐水时,酚酞变红的极是阴极,阴极和电源负极相连;
(2)电解硫酸铜溶液生成硫酸、铜和氧气;
(3)电解饱和食盐水,分别生成氯气、氢气;
(4)给铜镀银,阳极应为银,阴极为铜;
(5)氢氧化铁胶粒带正电荷,向阴极移动.
解答 解:将电源接通后,向乙中滴入酚酞试液,在F极附近显红色,说明F极生成OH-,F为阴极,则可知A为正极,B为负极,C、E、G、X为阳极,D、F、H、Y为阴极,
(1)由以上分析可知A是电源的正极,B是原电池的负极,故答案为:正极;
(2)电解硫酸铜溶液生成硫酸、铜和氧气,电解方程式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+H2SO4,故答案为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+H2SO4;
(3)电解饱和食盐水的电解原理是:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,产生的氢气和氯气体积比实施1:1,故答案为:1:1;
(4)给铜镀银,阳极应为银,阴极为铜,即G为银极,故答案为:银;
(5)根据异性电荷相吸的原理,氢氧化铁胶体中含有的带正电荷的粒子会向阴极即Y极移动,所以Y极附近红褐色变深,故答案为:Y极附近红褐色变深.
点评 本题考查电解原理,涉及电解和电镀,正确判断正负极及阴阳极是解本题关键,知道各个电极上发生的反应,会正确书写电极反应式,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 硅胶可用作干燥剂 | |
| B. | 二氧化硅可用作计算机的芯片 | |
| C. | 硅酸钠是制备木材防火剂的原料 | |
| D. | 用纯碱、石灰石、石英为原料可制普通玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1mol化合物Ⅰ能与4molH2发生完全加成反应
1mol化合物Ⅰ能与4molH2发生完全加成反应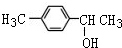 或
或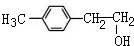 (写1种即可);由Ⅲ生成Ⅰ的反应条件为NaOH的乙醇溶液,加热.
(写1种即可);由Ⅲ生成Ⅰ的反应条件为NaOH的乙醇溶液,加热.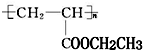 可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3;利用类似反应①的方法,以乙烯和乙醇为有机物原料合成该单体,该反应的化学方程式为2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件下}{→}$2CH2=CH-COOCH2CH3+2H2O.
可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3;利用类似反应①的方法,以乙烯和乙醇为有机物原料合成该单体,该反应的化学方程式为2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件下}{→}$2CH2=CH-COOCH2CH3+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+、H+、CO32-、Cl- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室中用铜片与稀HNO3反应制备NO2 | |
| B. | 常温下可以用铝制容器来盛装浓HNO3 | |
| C. | 实验室中用浓H2SO4干燥NH3 | |
| D. | 加热时,浓H2SO4不能将木炭氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取在空气中久置的碳酸钠晶体143.0g | |
| B. | 定容时,仰视观察刻度线 | |
| C. | 转移溶液时,用于溶解碳酸钠晶体的烧杯没有洗涤 | |
| D. | 定容后,将容量瓶震荡摇匀,静置时发现液面低于刻度线,于是又加少量水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
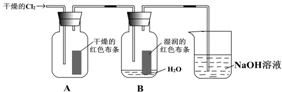 某同学设计了有关氯气的实验:
某同学设计了有关氯气的实验: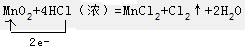
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com