
【题目】常见的太阳能电池有单晶硅或多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。请回答下列问题:
(1)基态硒原子的价电子排布式为___;H2O的沸点高于H2Se的沸点(-42℃),其原因是___。
(2)已知GaCl3晶体熔点为77.9℃,沸点为201.3℃,GaCl3品体类型为____。
(3)Na3AsO4中阴离子的空间构型为_____,As原子采取_____杂化。
(4)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:_____。
(5)锌与铜位于同一周期。硫化锌的晶胞结构如图所示,S2-周围等距离且最近的Zn2+个数为____;若晶胞边长为dpm,则硫化锌的密度为____g·cm-3(不必简化)。
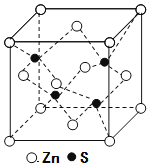
【答案】4s24p4 水分子之间存在氢键,H2Se分子之间不存在氢键 分子晶体 正四面体 sp3 Cu2O中Cu+价层电子排布处于稳定的全充满状态 4 ![]()
【解析】
(1)硒为34号元素,有6个价电子,所以硒的价层电子排布式为4s24p4;水分子之间存在氢键,H2Se分子之间不存在氢键,所以沸点高低:H2O>H2Se,故答案为:4s24p4;水分子之间存在氢键,H2Se分子之间不存在氢键;
(2)根据题中信息,GaCl3的熔点较低,GaCl3为分子晶体,故答案为:分子晶体;
(3)Na3AsO4中阴离子AsO43—,AsO43—中As原子价层电子对数为4,孤对电子数为0,所以As原子采取sp3杂化,AsO43—的空间构型为正四面体,故答案为:正四面体;sp3;
(4)原子轨道处于全空、半满或全满时最稳定,CuO中Cu2+的价层电子排布为3d9结构,而Cu2O中Cu+价层电子排布为全充满的3d10结构,更稳定,所以高温下CuO容易转化为Cu2O,故答案为:Cu2O中Cu+价层电子排布处于稳定的全充满状态;
(5)根据硫化锌晶胞结构图可知,每个Zn2+周围有4个S2-,每个S2-周围也有4个Zn2+;该晶胞中含有Zn2+数为8×![]() +6×
+6×![]() =4,含S2-数为4,则依据质量关系可得
=4,含S2-数为4,则依据质量关系可得![]() =(d×10-10cm)3ρ,则硫化锌的密度ρ=
=(d×10-10cm)3ρ,则硫化锌的密度ρ=![]() g·cm-3,故答案为:4;
g·cm-3,故答案为:4;![]() 。
。


科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1,该反应的平衡常数K=________(用K1、K2、K3表示)
CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1,该反应的平衡常数K=________(用K1、K2、K3表示)
(2)下列措施中,能提高(1)中CH3OCH3产率的有__________。
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,0.2molCO和0.1molH2O通入2L恒容密闭容器中,发生反应③,5分钟时达到化学平衡,平衡后测得H2的体积分数为0.1。则5分钟v(H2O)=_______________,CO的转化率α(CO)=___________。
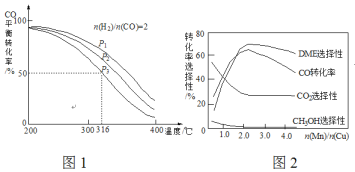
(4)将合成气以![]() =2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)
=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。
A.△H <0 B.P1>P2>P3
C.若在P3和316℃时,起始时![]() =3,则平衡时,α(CO)小于50%
=3,则平衡时,α(CO)小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察图2回答问题。催化剂中![]() 约为___________时最有利于二甲醚的合成。
约为___________时最有利于二甲醚的合成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,下列各溶液中有关微粒的物质的量浓度关系正确的是
时,下列各溶液中有关微粒的物质的量浓度关系正确的是![]()
![]()
A.向![]() 溶液中滴加NaOH溶液至恰好呈中性:
溶液中滴加NaOH溶液至恰好呈中性:![]()
B.![]() 溶液呈酸性:
溶液呈酸性:![]()
C.![]() 溶液与
溶液与![]() 溶液混合后的酸性溶液:
溶液混合后的酸性溶液:![]() COO
COO![]()
D.浓度均为![]() 的小苏打溶液与烧碱溶液等体积混合:
的小苏打溶液与烧碱溶液等体积混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知,常温下H2S、H2CO3的电离常数如表
Ka1 | Ka2 | |
H2S | 9.1×10-8 | 1×10-15 |
H2CO3 | 4.3×10-7 | 5.6×10-11 |
(1)①常温下,0.1 mol·L-1的硫化钠溶液和0.1mol·L-1的碳酸钠溶液,碱性更强的是_______。其原因是_____________________________。
②常温下,硫化钠水解的离子方程式为_____________________________。
(2)常温下,向100mL0.1mol·L-1H2S溶液中滴加0.1mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是________。
II.减少NO2、SO2、CO等有害气体对大气环境的危害,是人类的共同追求。
(3)以甲醇做燃料的电池,如图所示,其负极反应式为________,该燃料电池在理想状态下,将有96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,则通常甲醇燃烧的热化学反应方程式为________。

(4)已知:NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=+41.8kJmol﹣1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的________。
SO3(g)+NO(g) △H=+41.8kJmol﹣1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1molSO3的同时生成1molNO2
(5)当上述反应平衡时,测得NO2与SO2体积比为1:6,则平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是![]()
![]()
A.盐酸的导电能力一定比醋酸的导电能力强
B.一定量的锌粒与足量稀硫酸反应,向反应混合液中加入醋酸钠固体,产生![]() 速率减小,
速率减小,![]() 体积减小
体积减小
C.相同温度下![]() 氨水
氨水![]() 的浓度比
的浓度比![]() 溶液
溶液![]() 的浓度小
的浓度小
D.![]() 氨水可以使酚酞试液变红,证明
氨水可以使酚酞试液变红,证明![]() 是弱碱
是弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们对硒的性质深入认识及产品硒的纯度提高,硒的应用范围越来越广。某科学小组以硫铁矿生产硫酸过程中产生的含硒物料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)提取硒,设计流程如下:

回答下列问题:
(1)“脱硫”时,测得脱硫率随温度的变化如图。随着温度的升高,脱硫率呈上升趋势,其原因是______。最佳温度是________。

(2)“氧化酸浸”中,Se转化成H2SeO3,该反应的离子方程式为________。
(3)采用硫脲[(NH2)2CS]联合亚硫酸钠进行“控电位还原”,将电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离。下表是“氧化酸浸”液中主要粒子的电位。

①控制电位在0.740~1.511V范围内,在氧化酸浸液中添加硫脲,可选择性还原ClO2。该过程的还原反应(半反应)式为___________。
②为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在_____V。
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4酸化等步骤。
①净化后的溶液中c(Na2S)达到0.026 mol·L-1,此时溶液中的c(Cu2+)的最大值为________,精硒中基本不含铜。[Ksp(CuS)=1.3×10-36]
②硒代硫酸钠酸化生成硒的化学方程式为____________。
(5)对精硒成分进行荧光分析发现,精硒中铁含量为32 μg·g-1,则精硒中铁的质量分数为___________,与粗硒中铁含量为0.89%相比,铁含量明显降低。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向一定浓度的Na2X溶液中滴入盐酸,溶液的pH与离子浓度变化关系如图所示。

已知:H2X是二元弱酸,Y表示![]() 或
或![]() ,pY=﹣lgY.下列叙述不正确的是( )
,pY=﹣lgY.下列叙述不正确的是( )
A. 曲线n表示pH与p![]() 的变化关系
的变化关系
B. Ka2(H2X)=1.0×10﹣10.3
C. NaHX溶液中c(H+)>c(OH﹣)
D. 当溶液呈中性时,c(Na+)=c(HX﹣)+2c(X2﹣)+c(Cl﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某华人科学家和他的团队研发出“纸电池” (如图)。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为: Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是

A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生了氧化反应
C.电池的正极反应式为2MnO2 +2H2O+2e-= 2MnO(OH)+2OH-
D.当有0.1mol锌溶解时,流经电解液的电子数为1.204×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com