
| A. | FeCl2 | B. | Fe3O4 | C. | Fe(OH)3 | D. | Fe2(SO4)3 |
分析 化合反应是两种或两种以上的物质生成一种物质的反应;
置换反应是一种单质和一种化合物生成另一种单质和另一种化合物的反应;
复分解是两种化合物相互交换成分生成另外两种化合物的反应,据此分析.
解答 解:A、FeCl2可以由FeCl3和Fe的化合得到,也可以由Fe和HCl的置换得到,也可以由Fe(OH)2和HCl的复分解得到,故A正确;
B、Fe3O4能通过铁与氧气的化合反应得到,也能通过铁与水蒸气在高温条件下的置换反应得到,但无法通过复分解得到,故B错误;
C、Fe(OH)3可以通过Fe(OH)2和氧气、水的化合得到,也可以通过氯化铁与氢氧化钠的复分解得到,但无法通过置换得到,故C错误;
D、硫酸铁可以通过FeSO4溶液与氧气的化合得到,但无法通过置换得到,故D错误.
故选A.
点评 本题考查了物质的生成途径,掌握好常见的反应是解题的关键,难度不大.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:解答题
 某化学小组设计实验元素周期表中元素的性质,请回答下列问题
某化学小组设计实验元素周期表中元素的性质,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| H3BO3 | 5.7×10-10 | ||
| NH3•H2O | NH3•H2O?NH4++OH- | 1.76×10-5 | |
| H2O | Kw=1.0×10-14 | ||
| Mg(OH)2 | Mg(OH)2?Mg2++2OH- | 5.6×10-12 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
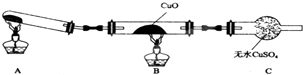 某校研究性学习小组的同学学习完氮的有关物质的性质之后,对氮元素的氢化物NH3性质的探究.
某校研究性学习小组的同学学习完氮的有关物质的性质之后,对氮元素的氢化物NH3性质的探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体摩尔体积为22.4L•mol-1 | |
| B. | 1molH2的质量是2g,它所占的体积是22.4L | |
| C. | 1mol水中含有2mol氢和1mol氧 | |
| D. | 在标准状况下,1mol任何气体所占的体积都约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯和环己烯都能使酸性高锰酸钾溶液褪色 | |
| B. | 用银氨溶液可以鉴别乙醛和麦芽糖溶液 | |
| C. | 甲醛和乙二醇都可作为合成高分子化合物的单体 | |
| D. | 丙烷和2-甲基丙烷的一氯代物均为两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 55 kJ | B. | 220 kJ | C. | 550 kJ | D. | 1108 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液能导电,所以氯化钠溶液是电解质 | |
| B. | 氯化钠固体不导电,所以氯化钠不是电解质 | |
| C. | 氯化氢溶液能导电,所以氯化氢是电解质 | |
| D. | 氯气溶于水能导电,所以氯气是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com