
| 操 作 | 现 象 |
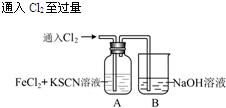 | I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
分析 (1)B装置是用来吸收氯气尾气的,根据元素守恒和电荷守恒可以写出离子方程式;
(2)Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化铁溶液,呈红色,据此答题;
(3)①A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,应当是氢氧化铁固体,所以原溶液中应当有Fe3+,据此答题;
(4)①根据SCN-的电子式为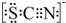 可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,不能再被氧化了,据此答题;
可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,不能再被氧化了,据此答题;
②加入用盐酸酸化的BaCl2溶液,产生白色沉淀,说明白色沉淀为硫酸钡,即溶液中有硫酸根离子,其中硫显+6价,而原来SCN-中硫显-2价,所以被氧化的元素为硫元素,据此答题;
③利用硝酸根离子在酸性条件下有强氧化性,遇到铜被还原,生成一氧化氮,在空气中被 氧化成红棕色的二氧化氮气体,可以检验硝酸根离子的存在,据此答题;
④SCN-与Cl2反应的化学方程式可以计算出电子转移的物质的量.
解答 解:(1)B装置是用来吸收氯气尾气的,根据元素守恒和电荷守恒可以写出离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(2)Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化铁溶液,呈红色,
故答案为:Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红;
(3)①A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,应当是氢氧化铁固体,所以原溶液中应当有Fe3+,
故答案为:Fe3+;
(4)①根据SCN-的电子式为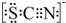 可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,不能再被氧化了,
可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,不能再被氧化了,
故答案为:SCN-中的碳元素是最高价态+4价;
②加入用盐酸酸化的BaCl2溶液,产生白色沉淀,说明白色沉淀为硫酸钡,即溶液中有硫酸根离子,其中硫显+6价,而原来SCN-中硫显-2价,所以被氧化的元素为硫元素,故答案为:硫元素;
③利用硝酸根离子在酸性条件下有强氧化性,遇到铜被还原,生成一氧化氮,在空气中被 氧化成红棕色的二氧化氮气体,可以检验硝酸根离子的存在,据此可知实验方案为:取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成,
故答案为:取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成;
④SCN-与Cl2反应生成硫酸根和硝酸根还有二氧化碳,所以它们反应的化学方程式为:SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+,此反应中电子转移数目为16,即由方程式可知每生成1mol二氧化碳要转移16mol电子,
故答案为:16.
点评 本题是实验方案的综合题,综合性较强,其中涉及到了离子的检验、氧化还原的离子方程式的书写、实验步骤的设计、化学计算等知识点,解题的关键是要掌握元素化合物的基础知识及实验基本操作要求.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量药品时,左盘放药品,右盘放砝码 | |
| B. | 向试管中滴加试剂时,将滴管下端紧靠试管内壁 | |
| C. | 使用试纸检验溶液的性质时,将试纸浸入溶液中 | |
| D. | 在容量瓶中直接溶解氢氧化钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②④ | C. | ③⑤ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
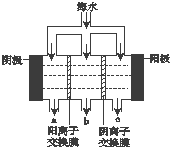 《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、SO42-、Cl- | B. | Na+、K+、CO32-、SO42- | ||
| C. | K+、NH4+、Cl-、NO3- | D. | Na+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2 CsCl CBr4 CF4 | B. | SiO2 CsCl CF4 CBr4 | ||
| C. | CsCl SiO2 CBr4 CF4 | D. | CF4CBr4CsCl SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质分子中一定存在共价键;最外层有2个电子的原子都是金属原子 | |
| B. | 非极性键可以存在于离子化合物中; 质子数相同的粒子不一定属于同种元素 | |
| C. | 同位素的化学性质几乎完全相同;任何原子的原子核都是由质子和中子构成的 | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构; 伴有能量变化的物质变化都是化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com