
25℃时,用0.1000mol·L-1NaOH溶液滴定20mL0.1000mol·L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示。下列说法正确的是
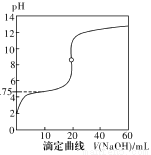
A.当滴入40mLNaOH溶液时,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
B.当溶液中c(H+)+c(OH-)=2×10-7时:c(Na+)>c(A-)>c(OH-)=c(H+)
C.当滴入NaOH溶液20mL时c(OH-)>c(H+)+c(HA)
D.当滴定到pH=4.75时,c(A-)=c(HA)
科目:高中化学 来源:2016届山西怀仁第一中学高三上学期期中考试化学试卷(解析版) 题型:选择题
二氧化硒( SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。在回收过程中涉及如下化学反应:①SeO2 + 4KI + 4HNO3 =Se + 2I2 + 4KNO3 + 2H2O;②Se + 2H2SO4(浓) = 2SO2↑+ SeO2 + 2H2O;③Se + 4HNO3(浓) = SeO2 + 4NO2↑+ 2H2O。下列有关叙述正确的是
A.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2
B.反应①中Se是氧化产物,I2是还原产物
C.反应①中生成0.6 mol I2,转移的电子数目为2.4NA
D.反应②、③中等量的Se消耗浓H2SO4和浓HNO3的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源:2016届江苏常州一中、江阴南菁高中高三两校联考化学卷(解析版) 题型:选择题
下列有关实验原理、方法和结论都正确的是
A.利用核磁共振氢谱图可鉴别1-溴丙烷和2-溴丙烷
B.将10%的氯化铁溶液加热蒸发可变为20%的氯化铁溶液
C.向C6H5ONa试液中通入少量CO2,生成C6H5OH和NaHCO3,则酸性:H2CO3>C6H5OH>HCO3-
D.常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则常温下Ksp(BaCO3)<Ksp(BaSO4)
查看答案和解析>>
科目:高中化学 来源:2016届河北正定中学高三上学期期中考试化学试卷(解析版) 题型:实验题
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为10 mL):
实验编号 | 实验温度/℃ | c(Na2S2O3)/mol·L-1 | c(H2SO4)/mol·L-1 |
① | 25 | 0.1 | 0.1 |
② | 25 | 0.2 | 0.1 |
③ | 25 | 0.1 | 0.2 |
④ | 50 | 0.2 | 0.1 |
⑤ | 50 | 0.1 | 0.1 |
其他条件不变时:探究温度对化学反应速率的影响,应选择_______________(填实验编号);
探究浓度对化学反应速率的影响,应选择_____ ___________(填实验编号);
___________(填实验编号);
若同时选择①②③溶液变浑浊的时间,探究_____________________对化学反应速率的影响。
(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子。该反应的离子方程式是_____________________________________________________________________________。
甲同学设计如下实验流程探究Na2S2O3的化学性质。

(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和_______________性。
(Ⅱ)加入BaCl2溶液生成白色沉淀B的离子方程式是_________________________________。
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是____________(填“甲”或“乙”),理由是__________________________________________。
查看答案和解析>>
科目:高中化学 来源:2016届贵州遵义航天高级中学高三第四次模拟考试理化学卷(解析版) 题型:实验题
(14分)某校课外探究小组欲在实验室条件下制取少量纯净的无水氯化铝。查阅到以下资料:无水氯化铝是白色晶体,易吸收水分,常压下在177.8℃升华,遇潮湿空气即产生大量白雾。用于有机合成和石油工业的催化剂,以及用于处理润滑油等。他们设计了以下装置,请结合题意回答问题:
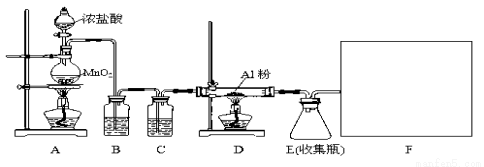
(1)A装置中发生反应的化学方程式为: 。
(2)装置B的作用是 。
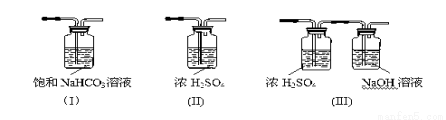
(3)请给标记为F的实线方框选择合适的装置 。
(4)AlCl3遇潮湿空气即产生大量白雾的原因是 (结合化学方程式说明)。
(5)有同学认为装置E中有不足之处,存在安全隐患。若你同意他的观点,请指出其不足之处 。
(6)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,该小组同学提出酸碱中和滴定法测定方案。方案如下:首先准确量取残余清液稀释一定的倍数后作为试样,平行做了4次滴定。实验中所用NaOH溶液浓度为0.2000mol·L-1,以下是实验记录与数据处理(不考虑NaOH与残液中其他成分的反应)。
滴定次数 实验数据ml | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(初读数) | 0.00 | 0.50 | 0.70 | 1.00 |
V(NaOH)终读数) | 22.60 | 22.55 | 22.65 | 23.00 |
①经计算,该次滴定测的试样中盐酸浓度为 mol·L-1。
②在本实验的滴定过程中,下列操作会使实验结果偏小的是 (填写序号)。
a.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失
b.未用标准NaOH溶液润洗滴定管
c.锥形瓶中加入待测盐酸后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前锥形瓶用待测盐酸润洗
f.观察读数时,滴定前仰视,滴定后俯视
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三12月月考化学试卷(解析版) 题型:选择题
将KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法正确的是
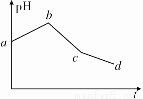
A.ab段表示电解过程中H+被还原,pH上升
B.电解开始时阳极先发生电极反应2Cl--2e-=Cl2↑
C.电解 至c点时,往电解液中加入适量CuCl2固体,即可使电解液
至c点时,往电解液中加入适量CuCl2固体,即可使电解液
恢复至原来的浓度
D.原混合溶液中KCl和CuSO4的浓度之比恰好为2∶1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南云天化中学高二12月月考理化学试卷(解析版) 题型:选择题
有4种有机物:①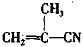 ②
② ③
③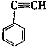 ④CH3-CH=CH-CN,其中可用于合成结构简式为
④CH3-CH=CH-CN,其中可用于合成结构简式为 的高分子材料的正确组合为
的高分子材料的正确组合为
A.①③④ B.②③④ C.①②④ D. ①②③
查看答案和解析>>
科目:高中化学 来源:2015-2016学年青海西宁第十四中学高二上期中考试化学卷(解析版) 题型:选择题
下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.化学反应中的能量变化都表现为热量变化
C.任何放热反应在常温下一定能发生反应
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西忻州第一中学高一上期中考试化学试卷(解析版) 题型:选择题
下列关于溶液和胶体的叙述,正确的是
A.溶液是电中性的,胶体是带电的
B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com