

| A.原子半径:W>Z>Y>X |
| B.相等物质的量浓度的气态氢化物溶液的pH: X>Z>W |
| C.最高价氧化物对应水化物的酸性:Z>W>X |
| D.四种元素的单质中,Z单质的熔沸点最低 |


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.比较这两种元素的单质的密度和熔点 |
| B.在氯化铝和氯化镁的溶液中分别滴加过量的氨水 |
| C.将空气中久置的镁带和铝片分别置于热水中,并滴入酚酞溶液 |
| D.用pH计分别测量相同物质的量浓度的氯化铝溶液和氯化镁溶液的pH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | | X | |
| Y | Z | | W |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该元素的单质性质活泼,具有较强的还原性,可以用于某些金属冶炼 |
| B.该元素的单质常温下不与浓硫酸反应 |
| C.该元素的单质无需特别保存,因为其性质稳定,不易与空气中的成分反应 |
| D.该元素的最高价氧化物对应的水化物只能与酸反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.食盐中阳离子的结构示意图为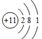 |
| B.蔗糖和醋酸都是电解质 |
| C.漂白粉的有效成分Ca(ClO)2是一种含氧酸盐 |
| D.明矾水解所得Al(OH)3胶体可用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解饱和食盐水时,溶液中的OH-向阴极移动 |
| B.需要加热才能发生的反应不一定是吸热反应 |
| C.短周期元素形成离子后,最外层都能达到8(或2)电子稳定结构 |
| D.金属单质Na、Mg、Fe在一定条件下与水反应都生成H2和相应的碱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.② | C.③④ | D.④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com