
【题目】短周期四种主族元素X、Y、Z、Q在周期表中的位置如图所示。X、Y、W的最外层电子数之和与Q原子核内质子数相等。下列说法中不正确的是( )
X | Y | ||
Z | Q | ||
W |
A. 离子半径![]() :r(Wm-)>r(Qm-)>r(Zn-)
:r(Wm-)>r(Qm-)>r(Zn-)
B. 元素Z和Y的化合价都可能存在![]() 价
价
C. 可以推测HWO4是W的最高价氧化物的水化物
D. X元素的氢化物种类繁多,大多可以与W元素的单质发生反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用。工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:
①CO(g)+2H2(g)CH3OH(g)△H1=-91kJmol-1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=-24kJmol-1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=-41kJmol-1
回答下列问题:
(1)写出新工艺的总反应的热化学方程式:______
(2)某温度下在2L恒容密闭容器中加入CH3OH发生反应②,测得有关数据如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 |
n(CH3OH)/mol | 1.02 | 0.42 | 0.22 | 0.02 | 0.02 |
①反应在2min内以CH3OCH3表示的化学反应速率为______
②该温度下的反应的平衡常数为______
(3)一定条件下的密闭容器中,在总反应达到平衡前,要使在单位时间内提高CO的转化率,可以采取的措施是______
A 增大压强 B 加入催化剂C 减少CO2的浓度 D 降低体系温度
(4)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果CO转化率随温度变化的规律如图1,试解释原因:______
(5)该研究者还测定了相同条件下氢气的残留量,请在图2中划出H2的残留量随温度变化的曲线______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、![]() (PAN)等二次污染物。
(PAN)等二次污染物。
① 1 mol PAN中含有的σ键数目为________。PAN中四种元素的第一电离能由大到小的顺序为________________。
② NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中的中心离子的配位数为________,中心离子的核外电子排布式为________________________。
③ 相同压强下,乙醇的沸点比CH3OCH3________(填“高”或“低”),其原因是_____________。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
① (NH4)2SO4晶体中各种微粒间的作用力不涉及________(填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
② NH4NO3中阳离子的空间构型为________,阴离子的中心原子轨道采用________杂化。
(3)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如下图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=____________(填数字)。
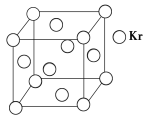
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室废液中含有Fe3+、Fe2+、Cu2+、Ag+四种金属阳离子,实验室设计了下述方案对废液进行处理,以回收金属,保护环境。
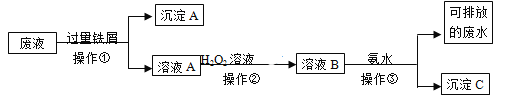
⑴沉淀A的成分是__________________________
⑵操作②中观察到的实验现象是__________________________________________________。
⑶设计一个实验方案,检验可排放的废水中不含Fe3+____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ·mol-1。在恒容密闭容器内,投入2mol N2和6mol H2发生反应,当反应达到平衡状态时,下列说法不正确的是
2NH3(g) △H=-92.4 kJ·mol-1。在恒容密闭容器内,投入2mol N2和6mol H2发生反应,当反应达到平衡状态时,下列说法不正确的是
A. 当其他条件不变的情况下,升高温度,原有的平衡被破坏,逆反应速率增大,正反应速率减小
B. 一定存在2v(H2)正=3 v(N2)逆
C. 反应过程中可能放出92.4 kJ的热量
D. 容器内混合气体的平均相对分子质量不再发生变化时,说明反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法.其反应过程如图所示:

(1)反应I的化学方程式是____________________。
(2)反应I得到的产物用I2进行分离.该产物的溶液在过量I2的存在下会分成两层-含低浓度I2的H2SO4层和含高浓度I2的HI层。
①根据上述事实,下列说法正确的是__________(选填序号)。
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是_______________________________。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1。其比值大于2的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某A在一定温度下有分解反应A(s) =B(s) + C(g) + 4D(g) 若测得生成的气体的质量是同温同压下相同体积氢气质量的10倍,且当所成气体在标准状况下的体积为22.4L时,所得B的质量为30.4g则A的摩尔质量是( )
A.130.4B.50.4C.182.4D.252
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】商代炼铜时,所用的矿物原料主要是孔雀石,主要燃料是木炭,在温度1000℃左右冶炼,可能涉及的反应有:
①Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O;
2CuO+CO2↑+H2O;
②2CuO+C![]() 2Cu+CO2↑;
2Cu+CO2↑;
③CuO+CO![]() Cu+CO2;
Cu+CO2;
④CO2+C![]() 2CO。
2CO。
(1)从四种基本反应类型来看,①②④的反应类型分别为①___________,②___________,④___________。
(2)反应③中,____________发生氧化反应,__________发生还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄酮类化合物具有抗肿瘤活性,6-羟基黄酮衍生物的合成路线如下:
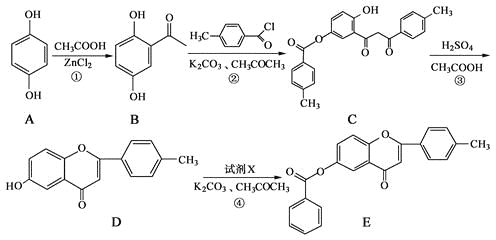
请回答下列问题:
(1)化合物B中的含氧官能团为_____和_____(填名称)。
(2)反应③中涉及到的反应类型有水解反应、_______和_______。
(3)反应④中加入的试剂X的分子式为C7H5OCl,X的结构简式为_______。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有4种不同化学环境的氢。
写出该同分异构体的结构简式:___。
(5)已知: 。
。
根据已有知识并结合相关信息,写出以![]() 和CH3COOH为原料制备
和CH3COOH为原料制备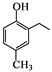 的合成路线流程图___(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图___(无机试剂任选)。合成路线流程图示例如下:
H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com