
| A.已知2H2(g)+O2(g)===2H2O(g);ΔH=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol |
| B.C(石墨,s)===C(金刚石,s);ΔH>0,所以金刚石比石墨稳定 |
| C.已知碳的燃烧热为ykJ/mol,当7.2g的碳在12.8g的氧气中燃烧,至反应物耗尽并放出xkJ的热量,则可求出1mol碳与氧气反应生成一氧化碳时ΔH=(0.5y-2.5x)kJ/mol |
| D.己知2C(s)+2O2(g)===2CO2(g);ΔH1 2C(s)+O2(g)===2CO(g);ΔH2,则ΔH1>ΔH2 |
科目:高中化学 来源:不详 题型:单选题
| A.-69.4 kJ/mol | B.-45.2kJ/mol |
| C.+69.4 kJ/mol | D.+45.2 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2(g) +
H2(g) +  F2 (g) = HF (g) △H = -269 kJ·mol-1
F2 (g) = HF (g) △H = -269 kJ·mol-1 O2(g) = H2O (g) △H = -242 kJ·mol-1
O2(g) = H2O (g) △H = -242 kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g),右下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),右下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
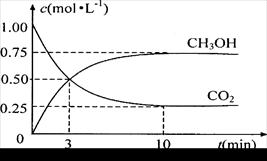
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.是吸热反应 | B.是放热反应 |
| C.是熵减小的反应 | D.熵增效应大于热效应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.不管反应是一步完成还是分几步完成,其反应热相同 |
| B.反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
| C.有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到 |
| D.根据盖斯定律,热化学方程式中△H直接相加即可得总反应热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com