
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应2A(g)+B(g) ![]() 2C(g),若2 s(秒)后测得C的浓度为0.6 mol/L,现有下列几种说法:
2C(g),若2 s(秒)后测得C的浓度为0.6 mol/L,现有下列几种说法:
①用物质A表示反应的平均速率为0.3 mol/(L·s)
②用物质B表示反应的平均速率为0.6 mol/(L·s)
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol/L
其中正确的是( )
A.①③
B.①④
C.②③
D.③④
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验.请回答下列问题: 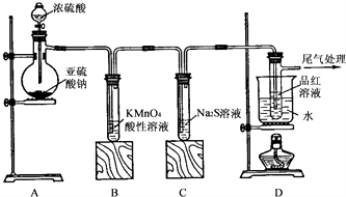
(1)装置A中盛放浓硫酸的仪器名称是;
(2)实验过程中,装置B中发生的现象是 , 说明 SO2具有性;装置C中发生的现象是 , 说明 SO2具有性;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象:;
(4)尾气可采用溶液吸收,反应方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系: 
(1)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体.写出②反应的离子方程式;④反应离子方程式 .
(2)若A是应用最广泛的金属.④反应用到A,②⑤反应均用到同一种黄绿色气体单质.写出A与水反应的化学方程式 . ④反应的离子方程式 . D中加入氢氧化钠的现象 .
(3)若A是太阳能电池用的光伏材料.C、D为钠盐,且溶液均显碱性.④反应也是通入一种引起温室效应的主要气体.写出②反应的化学方程式 . ⑤反应用到B,反应条件为高温,则⑤的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组依据反应:AsO43- + 2H+ + 2I- AsO33- + I2 + H2O设计如图原电池,探究pH对AsO43-氧化性的影响.测得电压与pH的关系如图.下列有关叙述错误的是( )
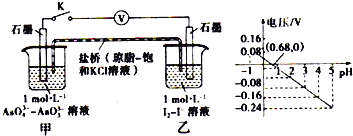
A. pH = 0.68时,反应处于平衡状态 B. 调节pH可以改变反应的方向
C. pH > 0.68时,负极电极反应式为2I——2e—═I2 D. pH = 5时,氧化性I2 > AsO43-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是( )
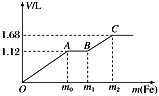
A. 开始时产生的气体为H2
B. AB段发生的反应为置换反应
C. 所用混合溶液中c(HNO3)=0.5 mol·L-1
D. 参加反应铁粉的总质量m2=8.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如下图所示,下列说法正确的是( )
A.向HB溶液中滴加NaOH溶液的过程中,水的电离程度一直增大
B.用pH为11的某碱与pH为3的HB溶液等体积混合后,溶液不可能显碱性
C.氨水与HA溶液混合后的溶液中可能存在:c(NH4+ )>c(A+)>c(H+)>c(OH-)
D.完全中和等体积等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com