
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2的化学方程式如下:2NO+2CO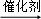 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
 请回答:以下各题(均不考虑温度变化对催化效率的影响):
请回答:以下各题(均不考虑温度变化对催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”).
(2)前2s内的平均反应速度v(N2)= .
(3)假设在容器中发生上述反应,达到平衡时下列能提高NO转化率的是 .
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
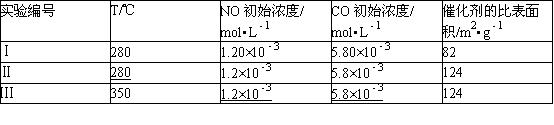 ①请在空格﹣﹣﹣﹣中填入剩余的实验条件数据.
①请在空格﹣﹣﹣﹣中填入剩余的实验条件数据.
②请在给出的坐标图中,画出表中的Ⅱ、Ⅲ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号.(见答题纸)
考点:化学平衡的影响因素;反应热和焓变;反应速率的定量表示方法.
分析:(1)依据反应自发进行的判断依据△H﹣T△S<0分析判断;
(2)依据化学反应速率的概念结合图表数据分析计算一氧化氮的反应速率,结合速率之比等于系数之比;
(3)提高NO转化率.平衡正向进行;
(4)①该实验是验证温度、催化剂比表面积对化学反应速率的影响规律,所以实验Ⅰ、Ⅱ是只改变催化剂表面积,实验Ⅱ、Ⅲ只改变温度,则物质的浓度数据相同,只有温度、接触面积两个变量;
②实验Ⅱ增大催化剂的表面积,反应速率加快,可缩短达平衡的时间,但平衡不移动,NO的平衡浓度和实验Ⅰ相同;实验Ⅲ,升高了温度,反应速率加快,可缩短达平衡的时间;该反应为放热反应,升温,平衡逆向移动,NO的平衡浓度增大,据此画出图象.
解答: 解:(1)2NO+2CO⇌2CO2+N2 反应的△S<0,反应自发进行△H﹣T△S<0,则反应焓变一定小于0,△H<0,故答案为:<;
(2)前2s内的平均反应速度v(NO)=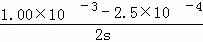 =3.75×10﹣4mol/L•s:v(N2):v(NO)=1:2得到v(N2)=1.875×10﹣4mol/L•s,
=3.75×10﹣4mol/L•s:v(N2):v(NO)=1:2得到v(N2)=1.875×10﹣4mol/L•s,
故答案为:1.875×10﹣4mol/L•s;
(3)2NO+2CO⇌2CO2+N2反应中能提高NO转化率,则
A.选用更有效的催化剂,只能改变反应速率,不能改变平衡,故A错误;
B.反应时放热反应,升高反应体系的温度,平衡逆向进行,一氧化氮转化率减小,故B错误;
C.反应时放热反应,降低反应体系的温度,平衡正向进行,一氧化氮转化率增大,故C正确;
D.缩小容器的体积,压强增大,平衡向气体体积见效的方向进行,平衡正向进行,一氧化氮转化率增大,故D正确;
故选CD;
(4)①实验目的为验证温度、催化剂比表面积对化学反应速率的影响规律,所以实验Ⅰ、Ⅱ应该只改变催化剂表面积,实验Ⅱ、Ⅲ中只改变温度,所以三组实验中各物质的物质的浓度数据相同,只有温度、接触面积两个变量,实验数据为:II:280、1.2×10﹣3、5.8×10﹣3;III:1.2×10﹣3、5.8×10﹣3,
故答案为:
 ②实验Ⅱ增大了催化剂的表面积,反应速率加快,可缩短达平衡的时间,但平衡不移动,NO的平衡浓度和实验Ⅰ相同;
②实验Ⅱ增大了催化剂的表面积,反应速率加快,可缩短达平衡的时间,但平衡不移动,NO的平衡浓度和实验Ⅰ相同;
实验Ⅱ、Ⅲ对比,实验Ⅲ,升高了温度,反应速率加快,可缩短达平衡的时间;
该反应为放热反应,升温,平衡逆向移动,NO的平衡浓度增大,则Ⅱ、Ⅲ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图为: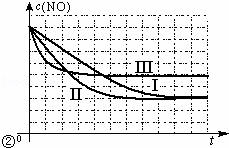 ,故答案为:
,故答案为: .
.
点评:本题综合考查了反应速率、反应方向、化学平衡等知识,并注重考查了学生对实验化学的设计思路,同时又注重了对2015届高考热点的考查,试题综合性较强、涉及的知识点较多,难度适中.


科目:高中化学 来源: 题型:
下列反应中,属于氧化反应的是( )
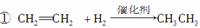
②2CH3CHO+O2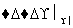 2CH3COOH
2CH3COOH
③CH3CHO+2Cu(OH)2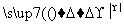 CH3COOH+Cu2O↓+2H2O
CH3COOH+Cu2O↓+2H2O
④CH3CHO+H2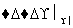 CH3CH2OH
CH3CH2OH
A.①② B.②③
C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容中发生下列反应aA(g)⇌cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A.A的转化率变小 B.平衡向正反应方向移动
C.D的体积分数变大 D.a>c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:2CH3COCH3(l)⇌CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y﹣t)如图所示.下列说法正确的是( )

A.b代表0℃下CH3COCH3的Y﹣t曲线
B.反应进行到20min末,CH3COCH3的
C.升高温度可缩短反应达平衡的时间并能提高平衡转化率
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值.下列说法正确的是 ( )
A.一定条件下,0.2mol SO2与足量O2充分反应,生成SO3分子数为0.2NA
B.0.1mol﹣NH2(氨基)中含有的电子数为0.7 NA
C.3.4克H2O2中含有的公用电子对数为0.1NA
D.常温常压下,16克O2和O3混合气体含有的氧原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点:
Na Cu Al Fe
熔点(℃) 97.5 1083 660 1535
沸点(℃) 883 2595 2200 3000
你判断其中不能形成合金的是( )
A. Cu和Al B. Fe和Cu C. Fe和Na D. Al和Na
查看答案和解析>>
科目:高中化学 来源: 题型:
将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则下列说法正确的是( )
A. 最终溶液:c(Na+)=1.5mol/L
B. 标准状况下,反应过程中得到6.72 L气体
C. 最终溶液:c(Na+)=c(Cl﹣)
D. 最终得到7.8 g沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
现有室温下两种溶液,有关叙述正确的是
| 编号 | ① | ② |
| pH | 12 | 2 |
| 溶液 | 氢氧化钠溶液 | 醋酸溶液 |
A.两种溶液中水的电离程度:①=②
B.两种溶液的浓度: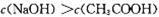
C.两种溶液等体积混合后: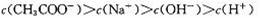
D.加水稀释相同倍数后: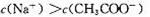
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com