
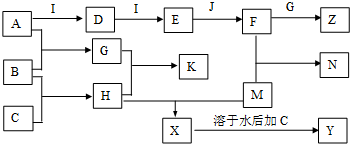
分析 A、B、C、D、E、G、H、I均为气体,A、B、C、I、M为单质,根据题中各物质转化关系,A和B反应生成G,B和C反应生成H,G和H相遇时产生白烟,则该反应为氨气与氯化氢的反应,所以K为NH4Cl,B为H2,A能与I连续反应,且E与J反应,J为常见的液态物质,所以I为O2,J为H2O,则A为N2,所以G为NH3,则H为HCl,D为NO,E为NO2,F为HNO3,F和G反应生成Z为NH4NO3,M能与H盐酸反应生成X,X可以继续与C反应,且M为常用金属,则M为Fe,所以X为FeCl2,Y为FeCl3,铁与硝酸反应生成N为Fe(NO3)3,据此答题.
解答 解:A、B、C、D、E、G、H、I均为气体,A、B、C、I、M为单质,根据题中各物质转化关系,A和B反应生成G,B和C反应生成H,G和H相遇时产生白烟,则该反应为氨气与氯化氢的反应,所以K为NH4Cl,B为H2,A能与I连续反应,且E与J反应,J为常见的液态物质,所以I为O2,J为H2O,则A为N2,所以G为NH3,则H为HCl,D为NO,E为NO2,F为HNO3,F和G反应生成Z为NH4NO3,M能与H盐酸反应生成X,X可以继续与C反应,且M为常用金属,则M为Fe,所以X为FeCl2,Y为FeCl3,铁与硝酸反应生成N为Fe(NO3)3,
(1)根据上面的分析可知,A为N2,K为NH4Cl,Z为NH4NO3,故答案为:N2;NH4Cl;NH4NO3;
(2)①实验室用氯化铵与氢氧化钙反应制取氨气,反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②实验室检验氨气是否收集满的方法可以用湿润的红色石蕊试纸置于集气瓶口,如果红色石蕊试纸变蓝,则说明收集满,
故答案为:用湿润的红色石蕊试纸置于集气瓶口,如果红色石蕊试纸变蓝,则说明收集满;
③氨气在一定条件下催化氧化也可生成NO,该反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6 H2O;
(3)过量的铁与稀硝酸反应生成硝酸亚铁,反应的离子方程式为3Fe+8H++2NO3-(稀)═3Fe2++2NO↑+4H2O,
故答案为:3Fe+8H++2NO3-(稀)═3Fe2++2NO↑+4H2O;
(4)检验FeCl3中的氯离子的方法为取少量样品试液,滴入硝酸酸化的硝酸银溶液,如果有白色沉淀产生,则说明原溶液中有氯离子,
故答案为:取少量样品试液,滴入硝酸酸化的硝酸银溶液,如果有白色沉淀产生,则说明原溶液中有氯离子;
(5)①浓硝酸与木炭在加热的条件下反应,反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H20,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H20;
②浓硝酸部分分解,溶液中含有少量的二氧化氮,所以溶液呈黄色,其化学方程式为4HNO3(浓)=O2+4NO2+2H20,
故答案为:4HNO3(浓)=O2+4NO2+2H20;
③若要消除黄色可向其中通入一定量的氧气,二氧化氮、氧气、水反应生成硝酸,故答案为:氧气.
点评 本题考查无机物的推断,明确物质的颜色及性质是解答本题的关键,注意B、K是解答本题的突破口,并规范化学用语的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 还原性:X的氢化物>Y的氢化物>Z的氢化物 | |
| B. | 简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 | |
| C. | YX2与M2Y的水溶液在酸性条件下不能反应 | |
| D. | Z元素最高价氧化物对应的水化物的化学式为HZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
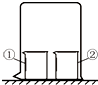 用图所示装置进行下列实验,实验结果与预测现象不一致的是( )
用图所示装置进行下列实验,实验结果与预测现象不一致的是( )| 选项 | ①中物质 | ②中物质 | 预测现象 |
| A | 酚酞溶液 | 浓氨水 | ①中无色变红色 |
| B | CCl4 | 液溴 | ①中变橙色 |
| C | 浓氨水 | 浓硫酸 | 空气中产生白烟 |
| D | NaAlO2溶液 | 浓盐酸 | ①中有白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3 | B. | 浓硫酸 | C. | NaCl | D. | NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应进行的过程中放出或吸收的热量称为反应热 | |
| B. | 在稀溶液中,1mol酸跟1mol碱发生中和反应所放出的热量叫做中和热 | |
| C. | 氢氧化钡晶体与氯化铵晶体混合是吸热反应 | |
| D. | 化学反应中的能量变化与参加反应的物质的量成正比 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,B为18电子分子,其结构式为
,B为18电子分子,其结构式为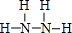 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,0.1mol•L-1HF溶液中pH=1 | |
| B. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| C. | 该体系中没有沉淀产生 | |
| D. | 该体系中有CaF2产生沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com