
【题目】下列各对物质中,互为同系物的是( )
A.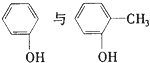
B.HCOOCH3与CH3CHOOH
C.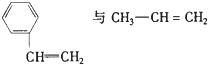
D.C6H5OH与C6H5CH2OH
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】下列实验基本操作(或注意事项)中,主要是出于实验安全考虑的是
A.实验剩余的药品不能放回原试剂瓶 B.可燃性气体的验纯
C.气体实验装置在实验前进行气密性检查 D.滴管不能交叉使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个体积为1 L的密闭容器中发生某化学反应:2A(g)![]() B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800° C,实验Ⅲ在950°C。B、C的起始浓度都为0,反应物A的浓度(mol L-1)随时间(min)的变化如图所示。试回答下列问题:
B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800° C,实验Ⅲ在950°C。B、C的起始浓度都为0,反应物A的浓度(mol L-1)随时间(min)的变化如图所示。试回答下列问题:
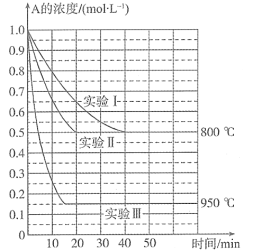
(1)在实验Ⅰ中,反应在2040 min内A的平均反应速率为________mol L-1min-1。实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是____________。
(2)该反应的ΔH___________0,其判断理由是_____________。
(3)实验Ⅰ第40 min末,若降低反应温度,达到新的平衡后,A的浓度不可能为________(填序号)。
A.0.35 mol·L1 B.0.4 mol·L1 C.0.7 mol·L1 D.0.8 mol·L1
(4)若反应在800°C进行,在该1 L的密闭容器中加入1 mol A、0.2 mol He,达到平衡时A的转化率应____________。
A.等于86% B.等于50% C.小于50% D.在50%86%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,K2MnO4溶液经酸化后转化为MnO2和KMnO4 . 一种MnO2制备KMnO4的方法如下: 
(1)写出“溶化氧化”的化学反应方程式:;
(2)从溶液②中得到KMnO4粗晶体的方法是;
(3)上述流程中可以循环使用的物质是;
(4)理论上(若不考虑制备过程中的损失与物质循环)1mol MnO2可制的mol KMnO4;
(5)已知293K时醋酸钾的溶解度为217g,硫酸钾的溶解度为11.1g,请解释酸化过程中采用醋酸而不采用盐酸或硫酸的原因: ①不采用盐酸的原因:;
②不采用硫酸的原因:
(6)采用上述流程制备KMnO4产率并不高,为提高产率,还可以采用以下两种方法: ①在K2MnO4溶液中通入氯气,写出该反应的离子方程式;
②电解K2MnO4溶液,电解的总反应离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.l mol Fe(NO3)3与足量HI溶液反应时转移的电子数为3NA
B.将lmol Cl2通入水中,HClO、Cl﹣、ClO﹣粒子数之和为2NA
C.分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA
D.将CO2通过Na2O2使其增重a克时,反应中转移电子数为 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应A2(g)+B2(g)![]() 2AB(g)达到平衡状态的标志是:( )
2AB(g)达到平衡状态的标志是:( )
A. 单位时间内生成 n mol A2,同时生成 n mol AB
B. 体系内的总压不随时间变化
C. 单位时间内生成2n mol AB的同时生成n mol B2
D. 单位时间内生成 n mol A2的同时,生成n mol B2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加0.1 mol MnO2粉末于50 mL过氧化氢溶液(H2O2,ρ=1.1 g·mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。
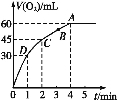
(1)实验时放出气体的总体积是 。
(2)放出一半气体所需时间为 。
(3)A、B、C、D各点反应速率由快到慢的顺序为 。
(4)解释反应速率变化的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示,下列说法正确的是( ) 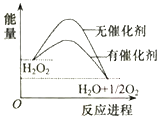
A.元素O的单质存在O2和O3两种同位素
B.加入催化剂,减小了H2O2分解反应的热效应
C.若H2O2分解产生1molO2 , 理论上转移4mol电子
D.H2O2和Na2O2所含化学键类型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的水溶液中,加入Ba(OH)2溶液后,原溶液中阴、阳离子个数都减少的是
A. CuSO4 B. Ca(NO3)2 C. Na2CO3 D. FeCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com