
下列实验操作或事实与预期实验目的或所得结论一致的是
选项 | 实验操作或事实 | 实验目的或结论 |
A | 淡黄色试液 | 说明原溶液中一定含有FeCl3 |
B | Br2 | 制备少量KBr溶液 |
C | 无色试液 | 说明原溶液中一定不含钾元素 |
D | H3PO3+2NaOH(足量)=Na2HPO3+2H2O | H3PO3属于三元酸 |
A. A B. B C. C D. D
科目:高中化学 来源:2017届陕西省高三3月月考理科综合化学试卷(解析版) 题型:选择题
利用下图装置收集气体并验证其某些化学性质,正确的是
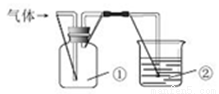
选项 | 气体 | 试剂② | 现象 | 结论 |
A | NH3 | 酚酞试液 | 溶液变红色 | NH3的水溶液显碱性 |
B | Cl2 | 紫色石蕊试液 | 溶液立即褪色 | Cl2有氧化性 |
C | SO2 | 溴水 | 溶液褪色 | SO2有漂白性 |
D | X(能形成酸雨) | KI淀粉溶液 | 溶液变蓝 | X是NO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省太原市高一3月阶段性测试化学试卷(解析版) 题型:选择题
某工厂运输NH3的管道出现小孔导致NH3泄漏,技术人员常常用一种液体进行检查,你觉得该液体最有可能是
A. 浓盐酸 B. 烧碱溶液 C. 浓硫酸 D. 碳酸钠溶液
查看答案和解析>>
科目:高中化学 来源:2017届新疆乌鲁木齐地区高三第二次诊断性测验化学试卷(解析版) 题型:选择题
下列有机反应:①甲烷与氯气光照反应 ②乙醛制乙酸 ③乙烯使溴水褪色 ④乙醇制乙烯 ⑤乙醛制乙醇 ⑥乙酸制乙酸乙酯 ⑦乙酸乙酯与NaOH溶液共热 ⑧液态植物油制人造脂肪 ⑨乙烯制乙醇的说法正确的是
A. ②⑤的反应类型相同 B. ⑥⑦的反应类型不同
C. ④与其他8个反应的类型都不同 D. ①③⑧属于同一种反应类型
查看答案和解析>>
科目:高中化学 来源:南开中学2016-2017高三第四次月考理综化学试卷 题型:填空题
平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:
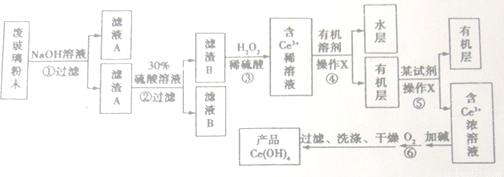
己知:
I.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式;
II. CeO2不溶于稀硫酸;利用有机溶剂可分离稀土元素如Ce等化合物。
请按要求回答下列问题:
(1) Ce的原子序数为58,它位于元素周期表中第______周期。
(2)步骤①、⑥反应的化学方程式分别为_________________、______________。
(3)检验滤渣B洗涤干净的方法是____________________。
(4)步骤③的离子方程式为____________________。
(5)操作X名称为_________________。
(6)在滤液B中加过量铁粉于50 °C水浴中加热充分反应后趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集得产品绿矾。
步骤②中的硫酸溶液过稀会导致____________;静置冷却一段时间后,在试管中观察到的现象是______________________。
(7)取2.08 g产品Ce(OH)4加过量稀硫酸溶解后,用0.1000 mol/L FeSO4溶液滴定至终点共消耗90.00mL,则产品中Ce(OH)4的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考试化学试卷(解析版) 题型:实验题
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
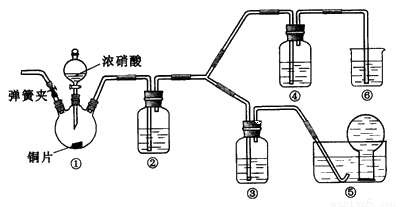
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应:2NO2+2NaOH=NaNO3+NaNO2+H,2O
(1)装置①中发生反应的离子方程式是 _______________________________________________________;
(2)装置②的目的是 ____________________,发生反应的化学方程式是 ____________________________________;
(3)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是 ____________;
(4)实验的具体操作是:先检验装置的气密性,再加入药品,然后____________________,__________________
(此操作的目的是 _______________________________________________),最后滴加浓硝酸;
(5)该小组得出的结论所依据的实验现象是 ________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考试化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是

A. 原子半径:X<Y<Z
B. 气态氢化物的稳定性:X>Z
C. 最高价氧化物对应水化物的酸性:Y>W
D. Z、W均可与Mg形成离子化合物
查看答案和解析>>
科目:高中化学 来源:广西南宁市2017届高三第一次模拟测试理综化学试卷 题型:实验题
某学习小组的同学拟利用碘化亚铁与碳酸氢钠的反应来制备高纯度的碘化钠晶体。回答下列问题:
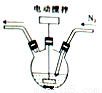
(1)碘化亚铁溶液的制备:将碘和铁粉按物质的量之比在 之间配料,加入三颈烧瓶中(如图),然后加入适量水,并向装置中持续通入N2,在40-60℃下搅拌反应30-50min,待反应完成检验出反应液中不含碘单质后,过滤即制得碘化亚铁溶液。
之间配料,加入三颈烧瓶中(如图),然后加入适量水,并向装置中持续通入N2,在40-60℃下搅拌反应30-50min,待反应完成检验出反应液中不含碘单质后,过滤即制得碘化亚铁溶液。
①配料中铁粉过量的目的是____________;持续通入N2的目的是___________。
②检验反应液中不含碘单质的方法是___________。
(2)碘化钠溶液的制备:将制备好的碘化亚铁溶液加入碳酸氢钠溶液中,控制碘化亚铁与碳酸氢钠的物质的量之比在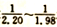 ,在80-100℃下,反应30-50 min,反应生成碘化钠及硫酸亚铁等。该反应的化学方程式为____________。
,在80-100℃下,反应30-50 min,反应生成碘化钠及硫酸亚铁等。该反应的化学方程式为____________。
(3)点化钠的提纯与结晶:
①除去碘化钠溶液中以HCO3-的方法是____________。
②从碘化钠溶液中获得碘化钠晶体(20℃时溶解度为179/100g水,100℃时溶解度为302/100g水)的操作方法是________________。
(4)碘化钠的提度的测定:
该小组同学称取制得的碘化钠晶体18.1g,溶于水后加入50mL2.5mol/LAgNO3溶液,过滤、洗涤、干燥,称得沉淀的质量为28.2g。则碘化钠晶体的纯度为_________。(杂质不参与反应,结果保留至小数点后两位)
查看答案和解析>>
科目:高中化学 来源:2017届福建省厦门市高三下学期第一次质量检测理综化学试卷(解析版) 题型:选择题
铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。若上端开口关闭,可得到强还原性的H+(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(烃基自由基)。下列说法错误的是
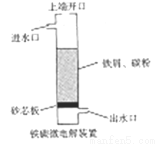
A. 无论是否鼓入空气,负极的电极反应式均为Fe-2e-=Fe2+
B. 不鼓入空气时,正极的电极反应式为H++e-=H·
C. 鼓入空气时,每生成1mol·OH有2mol电子发生转移
D. 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com