
| 1 |
| 2 |
| 1mol×70.74KJ |
| 0.25mol |
| 1 |
| 2 |
| 1mol×70.74KJ |
| 0.25mol |
| 1 |
| 2 |
| 1 |
| 2 |
| 5.4g |
| 108g/mol |
| 0.05mol |
| 2 |


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
| A、小于0.2mol |
| B、0.2mol |
| C、0.4mol |
| D、0.2mol和0.4mol之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
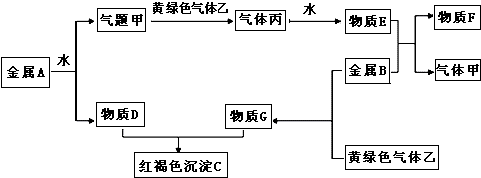
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| H+ |
| ①转化 |
2- 7 |
| fe2+ |
| ②还原 |
| 沉淀剂a |
| ③沉淀 |
| A、第①步当2c (Cr2O72-)=c(CrO42-)时,达到了平衡状态 |
| B、对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成 |
| C、Cr(OH)3是一种两性氢氧化物,所以像Al(OH)3一样能溶于氨水和碳酸溶液中 |
| D、第②步中,还原0.1 mol Cr2O72-需要91.2 g FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
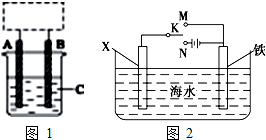 I.某学生设计了如图1所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4=H2↑+CuSO4,试回答:
I.某学生设计了如图1所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4=H2↑+CuSO4,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
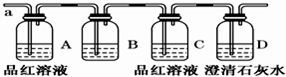
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com