
| A. | 钨的升华 | B. | 硅的熔化 | C. | 溴化氢溶于水 | D. | 食盐的溶解 |
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 |
| 向2mL 0.1mol/LBaCl2 溶液(填化学式)中通入SO2 | 试管内有白色沉淀产生 |
| 实验操作 | 实验数据 |
| 向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 | 图1:向BaCl2(无氧)溶液中通入SO2 |
| 向烧杯中分别加入25mL 0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线. | 图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2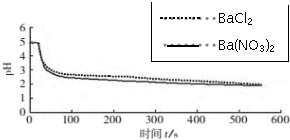 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

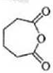 ;
;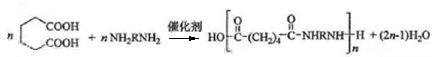 ;
; ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳碳键键长:乙烯>苯 | B. | 密度:一氯乙烷>一氯丁烷 | ||
| C. | 热稳定性:NaHCO3>Na2CO3>H2CO3 | D. | 沸点:H2O>H2S>H2Se |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 丙 | ||
| 甲 | 乙 |
| A. | 单质熔沸点从高到低:甲>乙>丙 | B. | 气态氢化物的热稳定性:丙>甲>乙 | ||
| C. | 元素最高价态:丙>乙>甲 | D. | 原子半径从大到小:甲>乙>丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 操作 | 现象 | 结论 |
| A | 甲醛溶液 | 加紫色石蕊溶液 | 变红 | 变质 |
| B | 亚硫酸钠溶液 | 加BaCl2 | 产生白色沉淀 | 变质 |
| C | 铁粉 | 加KSCN | 未变血红色 | 未变质 |
| D | 过氧化钠固体 | 加足量水 | 产生使带火星木条复燃的气体 | 未变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
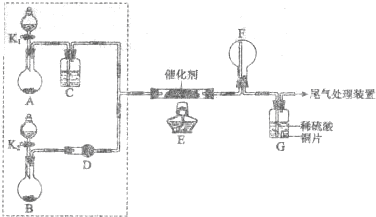

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.4 mo l•L-1 NaOH溶液 | B. | 5 mL 0.3 mo l•L-1 Na3PO4溶液 | ||
| C. | 10 mL 0.3 mo l•L-1 Na2SO4溶液 | D. | 5 mL 0.5 mol•L-1 NaNO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com